Нефтяной газ представлен в виде смеси углеводородов, поэтому для оценки его физико-химических свойств необходимо знать, как выражается состав смеси.
Массовая доля(gi) – отношение массы i- го компонента, содержащего в системе к бщей массе системы:
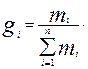
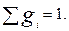 (3.5)
(3.5)
Молярная ( мольная ) доля(Ni) – отношение числа молей i-го компонента к общему числу молей в системе:
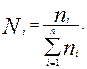
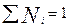 . (3.6)
. (3.6)
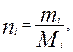 (3.7)
(3.7)
где mi – масса i-го компонента;
Mi – молекулярный вес.
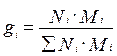 ,
, 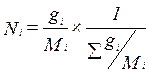 (3.8)
(3.8)
Объемная доля(Vi ) – доля, которую занимает компонент в объеме системы
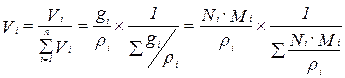 (3.9)
(3.9)
Для идеального газа соблюдается соотношение Vi=Ni .
Молекулярная массасмеси рассчитывается следующим образом:
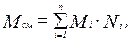
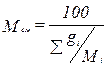 (3.10)
(3.10)
Относительная плотностьгаза по воздуху:
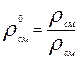 (3.11)
(3.11)
Для нормальных условий 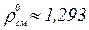 ; для стандартных условий
; для стандартных условий 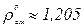 .
.
Если плотность газа задана при атмосферном давлении (0,1013 МПа ), пересчёт её на другое давление (при той же температуре) для идеального газа производится по формуле:
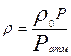 (3.12)
(3.12)
Смеси идеальных газов характеризуются аддитивностью парциальных давлений и парциальных объёмов.
Для идеальных газов давление смеси равно сумме парциальных давлений компонентов (закон Дальтона):
 (3.13)
(3.13)
где P – давление смеси газов;
pi – парциальное давление i-го компонента в смеси, или
pi=Ni· P. (3.14)
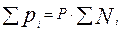 , где
, где 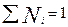 (3.15)
(3.15)
Т.е. парциальное давление газа в смеси равно произведению его молярной доли в смеси на общее давление смеси газов.
Аддитивность парциальных объёмов компонентов газовой смеси выражается законом Амага:
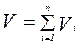 (3.16)
(3.16)
где V – объём смеси газов;
Vi – объём i – го компонента в смеси.
или
Vi = N i× V (3.17)
Для определения многих физических свойств природных газов используется уравнение состояния.
Уравнением состояния называется аналитическая зависимость между параметрами, описывающими изменение состояние вещества. В качестве таких параметров используется давление, температура, объём.
Состояние газа при стандартных условиях характеризуется уравнением состояния Менделеева – Клайперона:
PV=QRT, (3.18)
где P – абсолютное давление, Па;
V – объём, м 3 ;
Q – количество вещества, кмоль;
Т – абсолютная температура, К;
R – универсальная газовая постоянная Па×м 3/ (кмоль×град).
У этого уравнения есть свои граничные условия. За счёт направленности связи C-H происходит перераспределение электронной плотности, и молекулы газов начинают притягивать друг к другу.
Для учёта этого взаимодействия в уравнение (3.18) вводится коэффициент сверхсжимаемости z , предложенный голландским физиком Ван-дер-Ваальсом, учитывающий отклонения реального газа от идеального состояния:
PV = zQRT,
где Q – количество вещества, моль.
Физический смысл коэффициента сверхсжимаемости заключается в расширении граничных условий уравнения Клайперона-Менделеева для высоких давлений.
Коэффициент z зависит от давления и температуры, природы газа (критических давлений).
Критическое давление– давление, при котором газообразный углеводород переходит в жидкое состояние.
Критическая температура – температура, при которой жидкий углеводород переходит в газообразное состояние.
Приведёнными параметрами индивидуальных компонентов называются безразмерные величины, показывающие, во сколько раз действительные параметры состояния газа отклоняются от критических:
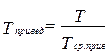 , где
, где  (3.20)
(3.20)
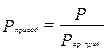 , где
, где 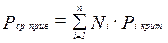 (3.21)
(3.21)
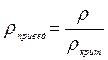 ,
, 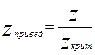 ,
, 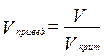 (3.22)
(3.22)
Существуют графики, эмпирические формулы и зависимости для оценки коэффициента сверхсжимаемости от приведённых давлений и приведённых температур.
Зная коэффициент сверхсжимаемости, можно найти объём газа в пластовых условиях по закону Бойля-Мариотта:
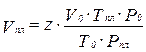 (3.23)
(3.23)
Объёмный коэффициент газа используется при пересчёте объёма газа в нормальных условиях на пластовые условия и наоборот (например, при подсчёте запасов):
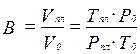 (3.24)
(3.24)
Вязкость газа– свойство газа оказывать сопротивление перемещению одной части газа относительно другой.
Различают динамическую вязкостьm и кинематическую вязкостьn.
Кинематическая вязкость учитывает влияние силы тяжести.
Динамическая вязкость зависит от средней длины пробега молекул газа и от средней скорости движения молекул газа:
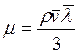 , (3.25)
, (3.25)
где r – плотность газа;
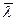 – средняя длина пробега молекулы;
– средняя длина пробега молекулы;
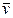 – средняя скорость молекул.
– средняя скорость молекул.
Дата добавления: 2015-08-08; просмотров: 1013;
