Состояние реальных газов
При повышенных давлениях для реальных газов характерно межмолекулярное взаимодействие, молекулы газов начинают притягиваться друг к другу, за счет физического взаимодействия.
Для учёта этого взаимодействия уравнение 2.17 на протяжении многих лет модифицировалось (голландским физиком Ван–дер–Ваальсом и др.). Однако на практике используется уравнениеМенделеева–Клапейрона для реальных газов, содержащее коэффициент сверхсжимаемости z, предложенный Д. Брауном и Д. Катцом и учитывающий отклонения поведения реального газа от идеального состояния:
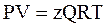 , (2.26)
, (2.26)
где Q – количество вещества, моль;
z – коэффициент сверхсжимаемости газа (см. 2.8).
Физический смысл коэффициента сверхсжимаемости заключается в расширении граничных условий уравнения Менделеева–Клапейрона для высоких давлений.
Коэффициент z зависит от давления и температуры (приведенных, критических давлений и температур), природы газа:
z = f (Тприв, Рприв), (2.27)
где Тприв – приведенная температура;
Рприв – приведенное давление.
Приведёнными параметрами индивидуальных компонентовназываются безразмерные величины, показывающие, во сколько раз действительные параметры состояния газа (температура, давление, объём, плотность и др.) больше или меньше критических.
Тприв.. = Тпл. / Тср. кр; Р прив. = Рпл. / Рср. кр; Vприв. = Vпл. / Vср. кр. (2.28)
А для смесей газов они характеризуются отношением действующих параметров (температура, давление и др.) к среднекритическим параметрам смеси:
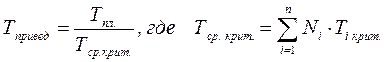 (2.29)
(2.29)
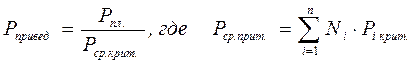 (2.30)
(2.30)
Критическая температура – температура, при которой жидкий углеводород переходит в газообразное состояние (табл. 2.4.).
Критическое давление – давление, при котором газообразный углеводород переходит в жидкое состояние (табл. 2.4).
Таблица 2.4
Дата добавления: 2015-08-08; просмотров: 804;
