Проводники первого и второго рода
Проводники– вещества, проводящие электрический ток благодаря наличию в них большого количества зарядов, способных свободно перемещаться (в отличие от изоляторов). Они бывают I (первого) и II (второго) рода. Электропроводность проводников I рода не сопровождается химическими процессами, она обусловлена электронами. К проводникам I рода относятся: чистые металлы, т. е. металлы без примесей, сплавы, некоторые соли, оксиды и ряд органических веществ. На электродах, выполненных из проводников I рода, происходит процесс переноса катиона металла в раствор или из раствора на поверхность металла. К проводникам II рода относятся электролиты. В них прохождение тока связано с химическими процессами и обусловлено движением положительных и отрицательных ионов.
Электроды первого рода.В случае металлических электродов первого рода такими ионами будут катионы металла, а в случае металлоидных электродов первого рода – анионы металлоида. Серебряный электрод первого рода Ag+/Ag. Ему отвечает реакция Ag+ + e- = Ag и электродный потенциал
EAg+ /Ag = Ag+ / Ag+b0lg a Ag+.
После подстановки численных значений Е 0 и b0 при 25 oС:
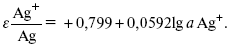
Примером металлоидных электродов первого рода может служить селеновый электрод Se2–/Se, Se + 2e- = Se2; при 25 oС ESe2–/Se0 = –0,92 – 0,03lg a Se2–.
Электроды второго рода– полуэлементы, состоящие из металла, покрытого слоем труднорастворимого соединения (соли, оксида или гидроксида) и погруженного в раствор, содержащий тот же анион, что и труднорастворимое соединение электродного металла. Схематически электрод второго рода можно представить так: АZ–/MA, M, а протекающую в нем реакцию – МА + ze = М + АZ–. Отсюда уравнением для электродного потенциала будет:
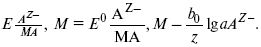
Каломельные электроды– это ртуть, покрытая пастой из каломели, и ртуть, находящаяся в контакте с раствором KCl.
Cl– / Hg2Cl2, Hg.
Электродная реакция сводится к восстановлению каломели до металлической ртути и аниона хлора:
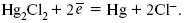
Потенциал каломельного электрода обратим по отношению к ионам хлора и определяется их активностью:
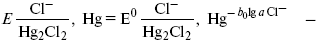
При 25 оС потенциал каломельного электрода находят по уравнению:
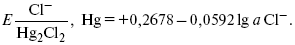
Ртутно-сульфатные электродыSO42 –/Hg2SO4, Hg аналогичны каломельным с той лишь разницей, что ртуть здесь покрыта слоем пасты из Hg и закисного сульфата ртути, а в качестве раствора используется H2SO4. Потенциал ртутно-сульфатного электрода при 25 oС выражается уравнением:
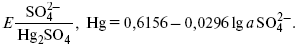
Хлорсеребряный электродпредставляет собой систему Cl–/AgCl, Ag, а его потенциалу отвечает уравнение:
ECl– /AgCl, Ag = E0Cl–/AgCl, Ag –b lg aCl–
или при 25 оС:
ECl–/AgCl, Ag = 0,2224 – 0,0592 lg a Cl–.
Дата добавления: 2015-08-08; просмотров: 1312;
