Электродные процессы
Электродные процессы– процессы, связанные с переносом зарядов через границу между электродом и раствором. Катодные процессы связаны с восстановлением молекул или ионов реагирующего вещества, анодные – с окислением реагирующего вещества и с растворением металла электрода.
Возможность протекания того или иного электродного процесса в общем случае определяется изменением ΔH и ΔS в ходе соответствующей химической реакции. Зная эти изменения, по уравнению Гельмгольца можно рассчитать минимальную величину напряжения, которое необходимо наложить на электроды для протекания данного электродного процесса. Например, на основании термодинамических данных для реакции 2Н2 + О2 = 2Н2О было установлено, что минимальное напряжение, необходимое для электрохимического разложения Н2О на Н2 и О2 =1,23В. Однако при таком напряжении между Hg катодом и Pt анодом для получения всего 1 см3 Н2 потребовалось бы около 400 тыс. лет. Чтобы увеличить скорость электродных процессов, не изменяя природы электродов, необходимо наложить на электроды значительно большую разность потенциалов. Например, для прохождения в рассмотренной системе электрического тока плотностью 1 А/см2 разность потенциалов между электродами должна составить 3,5 В. При этом только 35% электрической энергии затрачивается на реализацию электродного процесса, остальные 65% расходуются на нагревание электролита. Однако коэффициент полезного действия электрической энергии можно резко увеличить, если Hg катод заменить на Pt. Приведенный пример показывает, что термодинамический подход к изучению электродного процесса недостаточен.
Значительно большее значение имеет исследование кинетики электродных процессов. С помощью меченых атомов можно показать, что электродные процессы всегда идут в двух направлениях. Например, при восстановлении Cu2+ на медном электроде одновременно с реакцией Cu2+ + 2e- →Cu0 идет, хотя и с меньшей скоростью, ионизация Cu. При отсутствии внешнего тока скорости прямого и обратного электродного процесса равны между собой и равны плотности тока обмена, которая характеризует собственную скорость электродного процесса. При пропускании внешнего тока скорости электродного процесса в прямом и обратном направлениях различаются на величину плотности тока i. В этих условиях потенциал электрода отличается от своего равновесного значения. Сдвиг потенциала электрода от его равновесного значения при электродном процессе – поляризация. Абсолютная величина поляризации – η(перенапряжение). Чем больше плотность тока обмена, тем меньше при заданном значении iотклонение электрохимической системы от равновесия, и тем меньше перенапряжение. Таким образом, при заданном значении iвеличина ηхарактеризует собственную скорость данного электродного процесса. Поэтому задача электрохимической кинетики заключается в том, чтобы связать уравнением величину ηс плотностью тока и с другими параметрами электрохимической системы. Зная эту закономерность, можно сознательно регулировать скорость исследуемых электродных процессов. Электродные процессы – гетерогенные, и поэтому состоят из ряда последовательных стадий. Суммарная скорость электродного процесса в этих условиях определяется скоростью самой медленной стадии. Это означает, что суммарная величина ηскладывается из значений ηдля различных стадий: самая медленная стадия при заданной i даст самую большую составляющую η, по сравнению с которой другими составляющими ηпренебрегают.
Пример.Рассмотрим стадии электродного процесса на примере разряда ионов Н3О с образованием Н2 (газ).
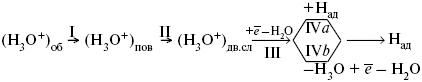
Стадия I – перенос ионов Н3О+ из объема раствора к поверхности электрода за счет диффузии под действием электрического поля (миграция) или за счет перемешивания раствора (конвекция). Если максимально возможная в данных условиях скорость переноса ионов Н3О+ соответствует плотности тока iд, то для стадии I:
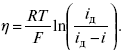
Стадия II – вхождение иона Н3О+ в ДЭС. Химические закономерности этой стадии были впервые рассмотрены В. Г. Левичем в 1949 г. Как показали более поздние исследования П. Делахея, скорость стадии II может существенно отразиться на общей скорости электродного процесса, лишь в случае электростатического отталкивания реагирующей частицы от электрода в условиях очень быстрой последующей стадии разряда (например, при разряде ионов Hg2+ на положительно заряженной поверхности Hg).
Стадия III – собственно электрохимическая стадия разряда. Медленность этой стадии в рассматриваемом примере обусловлена очень большой энергией связи протона с молекулой Н2О в разряжающемся ионе Н3О+. Согласно теории замедленного разряда, впервые предложенной М. Фольмероми Т. Эрдей-Грузомв 1930 г., а затем развитой А. Н. Фрумкиным в 1932 г. с учетом строения ДЭС для стадии III:
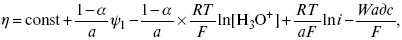
где α– const 0 < a <1;
ψ1 – потенциал на расстоянии среднего ионного радиуса от
поверхности электрода;
Wadc – энергия адсорбции атомов Н на поверхности металла.
Приведенное уравнение дает зависимость перенапряжения от плотности тока, состава раствора и природы металла (через Wadc) и в большинстве случаев хорошо согласуется с экспериментальными данными. В частности, стадия III определяет общую скорость электрохимической реакции при использовании в качестве электрода: Hg, Pb, Sn, Zn, Tl.
Стадия IVa – рекомбинация адсорбированных атомов водорода в молекулы Н2. Впервые выражение для этой стадии получил Ю. Тафель в 1905 г. В 1930 г. эта теория развилась в работе Н И. Кобозева и Н И. Некрасова, которые учли энергию адсорбции атомов Н на поверхности электрода. Стадия IVa:
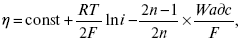
где п > 1 – const.
Одновременно Н И. Кобозевым и Н И. Некрасовым была рассмотрена возможность удаления адсорбции Н путем эмиссии атомов Н в раствор. Стадия IVa является заметным вкладом в суммарную величину ηпри использовании в качестве электродов металлов, которые хорошо адсорбируют водород: Pt, Fe, Ni.
Механизм удаления ад.Н, соответствует стадии IVб, был предложен Я. Гейровским в 1925 г. – электрохимическая десорбция. Поскольку в стадии IVб применяют участие ионы Н3О+ и электроны металла, то зависимость скорости этой стадии от состава раствора и от потенциала электрода такая же, как и в стадии III. Экспериментально существование стадии IVб было доказано для электродов из Fe и Ni.
Дата добавления: 2015-08-08; просмотров: 853;
