Закон Гесса
При изобарных и изохорных условиях теплота является функцией состояния.
В 1840 г. Г. Н. Гесс формулирует закон: «Тепловой эффект химической реакции не зависит от промежуточных стадий, а зависит только от начального и конечного состояния системы».
δQP = dH,
δQV = dUвн,
QP = ΔH,
QV = ΔUвн.
Современная формулировка закона Гесса– общие приращения энтальпии при переходе начальных веществ в продукты реакции не зависят от того, через какие промежуточные стадии прошла реакция.
Закон Гесса позволяет рассчитать тепловые эффекты или приращение энтальпии только при стандартных условиях (р = 1 атм = 105 Па, Т = 273 К + 25 = 298 К).
Теплоты при стандартных условиях сведены в таблицу (справочник под редакцией Нищенко). Для индивидуальных веществ: С, Н2, Fe и др. – ΔН = 0.
Следствия из закона Гесса:
1) энтальпия образования 1 моля соединения из простых веществ не зависит от способа получения;
2) теплоты сгорания – «теплота реакции равна сумме теплот сгорания исходящих веществ за вычетом теплот сгорания продуктов реакции с учетом стехиометрических коэффициентов»
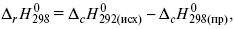
где r – реакции;
c – композиция;
3) теплоты образования – «тепловой эффект реакции равен разности между теплотами образования всех веществ, указанных в правой части уравнения (продукт реакции), и теплотами образования всех веществ, указанных в левой части уравнения».
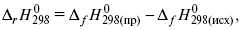
где f – формация.
Пример 1.Рассчитать тепловой эффект реакции этерификации спирта.
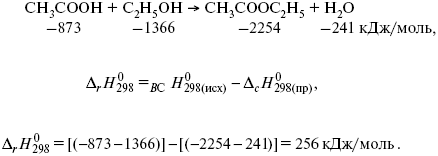
Пример 2.Рассчитать тепловой эффект реакции, протекающей по уравнению:
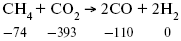
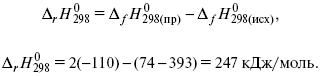
Дата добавления: 2015-08-08; просмотров: 1104;
