Хрящевой матрикс
Хрящевой матрикс содержит до 75% воды, что позволяет веществам из сосудов надхрящницы диффундировать в матриксе и осуществлять питание хондроцитов. Важное значение для обеспечения прочности и упругости хряща имеют белки хрящевого матрикса. Функционально наиболее значимы коллагены, протеогликаны и хондронектин.
Коллагены. Тип II, образующий коллагеновые волокна, составляет до 40% сухого веса хряща. Тип IX сшивает коллагеновые волокна. Его содержание в хряще в пять раз меньше, чем коллагена типа II. 2‑Цепь этого коллагена ковалентно связывает хондроитинсульфат. Тип VI найден в матриксе гиалинового и эластического хряща, а также в n. pulposus межпозвонкового диска. Тип X — редкая форма коллагена, с ним связывают способность некоторых хрящей к обызвествлению. Необызвествляющиеся хрящи (например, трахеи) не содержат этой формы коллагена.
Протеогликаны (рис. 6-46). Коллагеновые волокна погружены в макромолекулярные агрегаты протеогликанов — гигантских молекул, секретируемых хондроцитами. Главная функция протеогликанов — связывание воды в хрящевом матриксе и обеспечение диффузии. Основа протеогликана — гиалуроновая кислота. От неё в разные стороны отходят полипептидные цепи т.н. центрального белка. Длинные цепи центрального белка во множестве связывают боковые полисахаридные цепи (гликозаминогликаны). К глобулярному концу центрального белка присоединены короткие молекулы олигосахаридов, а к противоположному концу белка — хондроитинсульфаты. По всей длине центрального белка к нему прикреплены молекулы кератансульфата и олигосахаридов.
Агрекан — главный протеогликан хрящевого матрикса. Более сотни цепей хондроитинсульфата прикрепляются к центральному белку Mr 250 кД, формируя протеогликан Mr в 3000 кД. Многочисленные молекулы агрекана затем связываются с цепями гиалуроновой кислоты, формируя крупные агрегаты более 100 000 кД, которые фиксируются сетью коллагеновых волокон.
Сульфатирующие ферменты. Важную роль выполняют два сульфатирующих фермента, присоединяющие сульфатную группу SO42– к молекуле сахара в четвёртом (хондроитин-4-сульфат) или шестом (хондроитин-6-сульфат) положениях.
Генетические дефекты сульфатирующих ферментов известны у человека и у мутантных короткопалых мышей, когда из-за отсутствия полноценного хондроитинсульфата, а следовательно и протеогликана, нарушается хондрогенез, и развивается ненормально маленький плод с уродливыми конечностями.
Гликозаминогликаны.По мере дифференцировки хондроцитов качественный состав гликозаминогликанов изменяется. Так, цепи хондроитинсульфата в молекуле протеогликана, синтезируемого молодыми хондроцитами, примерно в два раза длиннее, чем в молекуле протеогликана, вырабатываемого более зрелыми клетками. Протеогликан молодых и гипертрофированных хондроцитов содержит относительно много хондроитин-6‑сульфата. Включение хондроитин-6‑сульфата в протеогликан в ходе дифференцировки хрящевых клеток уменьшается, но возрастает включение хондроитин-4‑сульфата. Молодые хондроциты синтезируют короткие цепи кератансульфата, а старые клетки синтезируют более длинные молекулы этого гликозаминогликана.
Вода и упругость хряща. Молекула протеогликана связывает (структурирует) большой объём воды, по массе намного превышающий её собственный. Количество структурированной воды определяет упругость хрящевой ткани. При сжатии хряща вода вытесняется из областей вокруг сульфатированных и карбоксильных групп протеогликана, группы сближаются, и силы отталкивания между их отрицательными зарядами препятствуют дальнейшему сжатию ткани. Вода возвращается на прежнее место при снятии давления. Таким образом, если коллаген определяет прочность хряща, то протеогликан — его упругость. Чем длиннее молекулы хондроитинсульфата в составе протеогликана, тем больше воды структурирует протеогликан. Поэтому протеогликан старых хондроцитов связывает меньше воды, вследствие чего хрящевой матрикс у пожилых людей становится менее упругим. Протеогликаны не только структурируют воду. Они занимают большой объём в пространстве тканевого матрикса и, взаимодействуя с коллагенами, регулируют толщину коллагеновых фибрилл (рис. 6-47). Кроме того, протеогликаны связывают отдельные компоненты матрикса в единую систему, усиливая взаимодействие между фибронектином и коллагеном.
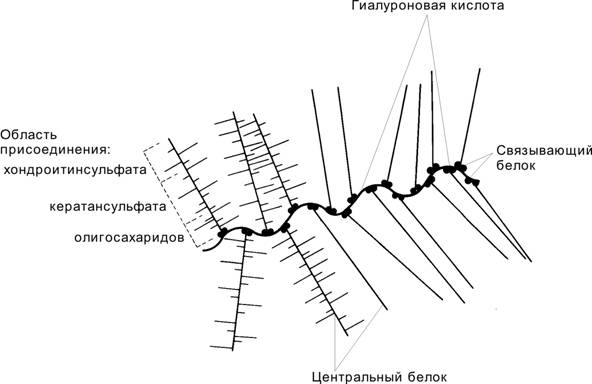
Рис. 6-46. Протеогликан хряща. Стержнем макромолекулы служит гиалуроновая кислота. К ней присоединены молекулы центрального белка, связанные с полисахаридами. [17]
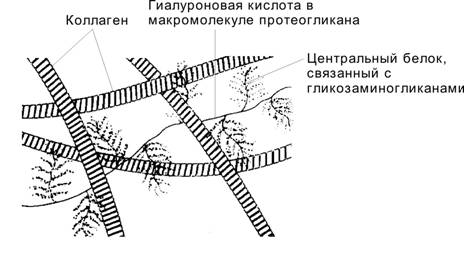
Рис. 6-47. Матрикс хряща.Протеогликаны взаимодействуют с коллагенами и регулируют толщину коллагеновых волокон. Связывание протеогликанами большого количества воды определяет упругость хрящевой ткани. [17]
Хондронектин, контролируя консистенцию матрикса, важен для развития хряща и поддержания его структуры. Молекула хондронектина имеет участки связывания коллагена типа II, протеогликанов и рецепторов хондронектина в плазмолемме хондроцитов. Таким образом, функции хондронектина аналогичны фибронектину и ламинину. Если фибронектин связывает клетки с коллагеном типа I, а ламинин — эпителиальные клетки с коллагеном типа IV, то хондронектин специфичен в отношении хондроцитов и коллагена типа II.
Дата добавления: 2015-07-07; просмотров: 5849;
