Уравнение изотермы химической реакции
Если реакция протекает обратимо, то ΔG= 0.
Если реакция протекает необратимо, то ΔG≤ 0 и можно рассчитать изменение ΔG.
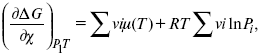
где χ – пробег реакции – величина, которая показывает, сколько молей изменилось в ходе реакции. I сп – характеризует равновесное и неравновесное состояние реакции, II сп – характеризует только неравновесные состояния.
Если
дχ = 1,
то
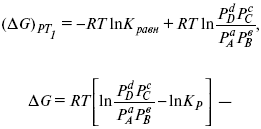
это уравнение изотермы химической реакции.
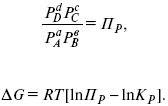
С помощью уравнения изотермы химической реакции можно судить о направлении протекания реакции.
1) Пp< Кp, ΔG < 0, слева направо;
2) Пp> Кp, ΔG > 0, справа налево;
3) Пp= Кp, ΔG = 0, химическое равновесие.
Дата добавления: 2015-08-08; просмотров: 717;
