Морфология
Ядро зрелой клетки — сегментоядерного нейтрофила — состоит из 3–5 сегментов, соединённых тонкими перемычками, хроматин сильно конденсирован. В нейтрофилах у женщин один из сегментов ядра содержит вырост в форме барабанной палочки — тельце Барра. Тельце Барра заметно у 3% нейтрофилов в мазке крови женщин.
В крови также содержатся палочкоядерные нейтрофилы — незрелые формы клеток с подковообразным ядром. В норме их количество составляет 3–6%. Нейтрофил содержит большое количество гликогена. Энергия, полученная путём гликолиза, позволяет клетке существовать в бедных кислородом повреждённых тканях. Количество митохондрий и органелл, необходимых для синтеза белка, минимально; поэтому нейтрофил не способен к продолжительному функционированию. В плазмолемму нейтрофилов встроены рецепторы молекул адгезии, цитокинов, колониестимулирующих факторов, опсонинов (Fc–фрагментов IgG и белков комплемента), медиаторов воспаления.
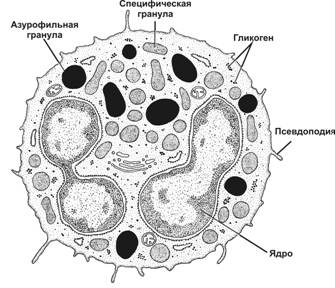
Рис. 6-3. Нейтрофил.Ядро состоит из 3–5 сегментов, соединённых тонкими перемычками. В цитоплазме — минимальное количество органелл, но много гранул гликогена. Нейтрофил содержит небольшое количество азурофильных гранул и многочисленные мелкие специфические гранулы. [17]
Азурофильные гранулы (красновато-пурпурного цвета на окрашенном мазке) — специализированные лизосомы нейтрофилов. Азурофильные гранулы являются основным депо лизосомных кислотозависимых гидролаз, содержат мембранные белки лизосом CD63/LAMP3 и CD68; однако, LAMP1 или LAMP2, типичные для лизосом, отсутствуют. Азурофильные гранулы содержат различные белки, разрушающие компоненты внеклеточного матрикса и обладающие антибактериальной активностью. В гранулах присутствуют миелопероксидаза, протеиназа 3 (миелобластин), азуроцидин, эластаза, катепсины A, C, D, E, G, L, дефензины, катионные белки, лизоцим, арилсульфатаза.
Дефекты азурофильных гранул характерны для синдрома Шедьяка–Хигаши. Ген CHS1, ассоциированный с синдромом, кодирует LYST — цитоплазматический белок 430 кД, участвующий в формировании вакуолей и транспорте белков. При синдроме нарушена направленность миграции нейтрофилов при хемотаксисе вследствие дефекта сборки микротрубочек.
Миелопероксидаза (MPO) составляет 2–4% массы нейтрофила, катализирует образование хлорноватистой кислоты HOCl и других токсических агентов, значительно усиливающих бактерицидную активность нейтрофилов. Недостаточность миелопероксидазы — причина снижения или отсутствия сопротивляемости организма к бактериальной и грибковой инфекциям. Врождённая недостаточность миелопероксидазы возникает в большинстве случаев вследствие мутация гена MPO. Нейтрофилы с дефицитом миелопероксидазы продуцируют необходимое количество H2O2, но не способны конвертировать H2O2 в HOCl.
Протеиназа 3 (миелобластин) (PRTN3) усиливает воспаление; расщепляет эластин. При гранулёматозеВегенера в организме появляются аутоантитела против протеиназы 3.
Азуроцидин (NAZC) — сериновая протеаза сантибактериальной активностью (белок с Mr 29 кД).
Эластаза нейтрофилов (медуллазин) (ген ELA2) — сериновая протеаза, в большом количестве содержащаяся совместно с азуроцидином и протеиназой 3 в азурофильных гранулах. Кроме азурофильных гранул, эластаза также может иметь мембранную локализацию. Эластаза осуществляет протеолиз коллагена типа IV, эластина и других белков внеклеточного матрикса, что происходит при дегенеративных и воспалительных заболеваниях. Эластаза разрушает наружный мембранный белок A (OmpA) поверхности грамотрицательных бактерий, модифицирует функции моноцитов, гранулоцитов, NK–клеток.
Мутации ELA2 являются причиной циклического гемопоэза (циклической нейтропении) и тяжёлой врождённой нейтропении. При циклическом гемопоэзе выброс лейкоцитов из костного мозга происходит с периодичностью в 21 день. Количество циркулирующих нейтрофилов варьирует от нормального до нуля. В периоды нейтропении у больных резко возрастает риск развития оппортунистических инфекций. Количество моноцитов, лимфоцитов, ретикулоцитов, тромбоцитов колеблется с той же цикличностью.
Дефензины повышают проницаемость мембран грамотрицательных бактерий.
Катепсин C(CTSC) (дипептидилпептидаза I, DPPI) — лизосомная протеаза, функция которой заключается в отщеплении дипептидов у белкового субстрата, обладает также эндопептидазной активностью. Кроме нейтрофилов, ген CTSC экспрессируется в высокой степени макрофагами и их предшественниками, а также в участках эпителия, вовлекаемых в синдром Лефевра–Папийона. Синдром Лефевра–Папийона (Папийона–Лефевра кератодермия) — наследственная болезнь, характеризующаяся ороговением кожи ладоней и подошв в сочетании с почти полным выпадением зубов вследствие разрушения альвеолярных отростков челюстей; наследуется по аутосомно-рецессивному типу. Синдром ассоциирован с мутациями гена катепсина C.
Катепсин G при нейтральном рН убивает грамположительные и грамотрицательные бактерии. Дефицит катепсина G и связанное с ним нарушение бактерицидной активности нейтрофилов обнаружены при синдроме Шедьяка–Хигаши.
Катепсин L (CTSL) — лизосомный белок семейства цистеиновых протеиназ, играет большую роль во внутриклеточном катаболизме белка. Катепсин L протеолитически инактивирует ингибитор -1 протеазы — главный контролирующий элемент активности эластазы нейтрофила. Субстратом катепсина L могут быть также эластин и коллаген. Катепсин L вовлечён в различные патологические процессы, в том числе в некроз миофибрилл при миопатиях и при ишемии миокарда, а также в реакции канальцев почки на протеинурию.
Лизоцим разрушает стенку бактерий (лизис).
Повышающий проницаемость бактерий белок BPI (Bactericidal Permeability-Increasing protein) (надсемействоbpi/lbp/plunk, семейство bpi/lbp) обладает бактерицидной активностью по отношению к грамотрицательным микроорганизмам; связывает липополисахариды (LPS) наружной оболочки бактерий.
Специфические гранулы (окрашиваемые в оранжево-розовый цвет) значительно мельче азурофильных, но вдвое многочисленнее. Гранулы содержат белки, обладающие бактериостатическими свойствами и разрушающие внеклеточный матрикс: лактоферрин, витамин B12‑связывающие белки, лизоцим, металлопротеиназы (желатиназу и коллагеназу, липокалин), щелочную фосфатазу, катионные белки (кателицидин).
Лактоферрин имеет выраженные бактериостатические свойства за счёт связывания металлосодержащих факторов роста микроорганизмов; связывает также свободные радикалы, продуцируемые нейтрофилами и повреждающие как сами клетки, так и окружающие ткани.
Витамин B12-связывающие белки. Пример подобных белков в составе специфических гранул — транскобаламин I, возможно, ингибирующий кобальт-зависимые реакции свободных радикалов.
Металлопротеиназы. Желатиназа и коллагеназа разрушают белки внеклеточного матрикса, могут активировать хемокины.
Липокалин 2 (онкоген 24p3, ассоциированный с нейтрофильной желатиназой липокалин, утерокалин, NGAL) (ген LCN2) — связывает бактериальные катехолатного типа сидерофоры, являясь мощным бактериостатическим агентом в условиях с ограниченным содержанием железа. Связывание липокалина 2 с бактериальными сидерофорами и угнетение роста бактерий — одно из центральных звеньев врождённого иммунитета.
Кателицидин (LL-37, порцин) (ген CAMP) — катионный белок 18 кД, антибактериальный белок специфических гранул нейтрофилов, связывается с бактериальными LPS. Вне клетки CAMP расщепляется протеиназой 3 (или другими сериновыми протеазами азурофильных гранул) с образованием антимикробного белка LL-37. Кателицидин не только проявляет мощную бактерицидную активность против грамотрицательных и грамположительных бактерий, но также является хемоаттрактантом для клеток иммунной защиты.
Рецепторы.В плазмолемму нейтрофилов встроены рецепторы молекул адгезии, цитокинов, колониестимулирующих факторов (CSF), опсонинов, медиаторов воспаления и бактериальных продуктов.
Рецепторы колониестимулирующих факторов G-CSF, GM-CSFэкспрессируют не только предшественники нейтрофилов, но и дифференцированные клетки. G-CSF и GM-CSF усиливают функцию нейтрофила, повышая активность комплекса НАДФH-оксидазы. Синдром Костманна развивается при точечной мутации гена рецептораG-CSF.
Рецепторы опсонинов связывают Fc–фрагменты IgG, белки комплемента C3a, C3b, C3bi, C4b, C5a.
Рецепторы медиаторов воспаления, например, лейкотриена В4, фактора активации тромбоцитов, C5a.
Рецепторы хемоаттрактантов, например, f-Met-Leu-Phe (табл. 6-4).
Активация и хемотаксис. Биологически активные соединения различного происхождения (например, содержимое гранул тромбоцитов, метаболиты арахидоновой кислоты, продукты жизнедеятельности бактерий), воздействуя на нейтрофилы,стимулируют их активность. Многие из этих веществ в то же время являются хемоаттрактантами, по градиенту концентрации которых происходит миграция нейтрофилов (табл. 6-5). Важное значение среди хемоаттрактантов имеют N–формилметионилпептиды (например, f-Met-Leu-Phe), образуемые при расщеплении бактериальных белков или белков митохондрий (при повреждении клеток).
Рецепторы N–формилметионилпептидов. Связывание с этими рецепторами их лигандов приводит к активации нейтрофилов (выход из сосудистого русла, миграция в очаг воспаления, дегрануляция нейтрофилов, образование супероксидов).
Таблица 6-5. Факторы хемотаксиса нейтрофилов
| Вещество | Источник |
| N–формил-метионил пептиды (например, f-Met-Leu-Phe) | Продукт распада бактериальных белков и белков митохондрий |
| C5a, C5a-des-Arg* | Продукты метаболизма компонентов комплемента |
| Фактор 4 тромбоцитов | Тромбоциты |
| Фактор роста из тромбоцитов (PDGF) | Тромбоциты |
| Фактор активации тромбоцитов (PAF) | Тромбоциты, моноциты, макрофаги |
| Метаболиты арахидоновой кислоты (например, лейкотриен LTB4) | Активированные нейтрофилы и др. клетки крови |
| Фактор хемотаксиса эозинофилов (ECF) | Тучные клетки |
| Фактор хемотаксиса нейтрофилов (NCF) | Тучные клетки |
| Лимфокины | Стимулированные Аг или митогенами T–лимфоциты |
* C5a-des-Arg — белок комплемента C5a без концевого аргинина
Адгезия. Активированный нейтрофил прикрепляется к эндотелию сосуда в участке, ближайшем к месту воспаления. Адгезию к эндотелию стимулируют многие агенты: анафилатоксины, ИЛ1, тромбин, фактор активации тромбоцитов (PAF), TNF, лейкотриены LTC4 и LTВ4 и др. Начальное взаимодействие между нейтрофилом и эндотелиальной клеткой опосредовано селектинами. Они индуцируются на эндотелии медиаторами воспаления и связываются с молекулами адгезии, в т.ч. интегринами, нейтрофила. К семейству ß2-интегринов нейтрофила относятся молекулы адгезии LFA-1 (CD11a/CD18), Mac-1 (CD11b/CD18, CR3), p150 (CD11c/CD18, CR4) и CD11d/CD18. Все 4 молекулы участвуют в адгезии нейтрофила к эндотелиальной клетке. Плотная адгезия опосредуется молекулами адгезии VCAM, ICAM эндотелия, связывающимися с интегринами нейтрофилов: LFA-1 связывает ICAM-1, а Mac-1 связывает ICAM-2. Связывание усиливается конформационными изменениями в интегринах в ответ на хемокины и усилением экспрессии ICAM в ответ на медиаторы воспаления. После связывания интегринов с ICAM нейтрофил останавливается, меняет форму (распластывается) и проходит между эндотелиальными клетками, взаимодействуя с ними через тромбоцит-эндотелиальная клетка молекулу адгезии 1 (PECAM-1) (Platelet-Endothelial Cell Adhesion Molecule-1). Для разрушения базальной мембраны нейтрофил секретирует гидролазы.
Недостаточность адгезии лейкоцитов (LAD) (Leukocyte Adhesion Deficiency) обусловлена дефектами экспрессии или функции молекул адгезии: LAD I развивается вследствие мутации гена, кодирующего CD18 (ITGB2) — общую-субъединицу для всех 2-интегринов, в результате недостаточна экспрессия всех 2-интегринов. В отсутствие адгезии наблюдается значительная недостаточность трансэндотелиальной миграции нейтрофила, что клинически проявляется в виде возвратных инфекций.
Миграция. После прикрепления к эндотелию и выхода из сосуда нейтрофилы увеличиваются в размерах, удлиняются и становятся поляризованными, образуя широкий головной конец (ламеллоподия) и суженную заднюю часть. Быстрое изменение формы нейтрофила происходит в ответ на сигналы, поступающие из очага воспаления. Нейтрофил, продвигая вперёд ламеллоподию, мигрирует к источнику хемоаттрактанта. При этом гранулы перемещаются к головному концу, их мембраны сливаются с плазмолеммой, и происходит выброс содержимого гранул (в т.ч. протеаз) из клетки (дегрануляция).
В изменении формы активированного нейтрофила участвует кальпаин — нелизосомная цистеиновая Ca2+-связывающая протеаза, присутствующая в цитоплазме клетки. Высокая активность кальпаина в покоящихся нейтрофилах угнетает образование псевдоподий и миграцию клеток. Подавление активности (ингибирование) кальпаина способствует поляризации и миграции нейтрофила. Кальпаин регулирует направленную миграцию нейтрофила по градиенту концентрации хемоаттрактанта, модулируя активность Rho ГТФаз Cdc42 и Rac. Активность кальпаина в активированном нейтрофиле проявляется асимметрично. В результате взаимодействия с хемоаттрактантом в ведущем крае поляризованного нейтрофила падает содержание фосфоинозитолфосфата, что ведёт к снижению активности кальпаина, тогда как в задней суженной части эта активность остается высокой. Такая асимметричная активность кальпаина может направлять движение клетки, регулируя образование псевдоподий и активацию Cdc42 и Rac на ведущем конце, в то же время предотвращая активность ГТФаз в задней части клетки.
Кальпаины (CAPN) (гены NCL) относятся к нелизосомным цистеиновым протеазам, активность которых регулируется Ca2+. CAPN1 и CAPN2 экспрессируются в различных клеточных типах; CAPN3 преобладает в скелетных мышечных волокнах. Молекула кальпаинов представляет собой гетеродимер, образованный неизменной малой субъединицей и вариабельной большой субъединицей. Большая субъединица содержит домен цистеиновой протеазы; обе субъединицы содержат Ca2+-связывающие домены. Кальпаины — протеазы, участвующие в таких клеточных процессах, как апоптоз, пролиферация, адгезия, распластывание клетки с последующей миграцией. Кальпаины контролируют клеточную миграцию, регулируя динамику повторных циклов сборки и разборки интегриновых комплексов адгезии, с одной стороны, и формирования (с участием актина) псевдоподий, с другой стороны. Активность кальпаинов играет центральную роль в миграции лейкоцитов, внося вклад в развитие воспаления. Кальпаины участвуют в регуляции миграции опухолевых клеток и их инвазивных свойств. Продукты экспрессии многих генов, ассоциированных с канцерогенезом (в том числеFos, Jun, p53, ESR1), являются субстратом для кальпаинов.
Побочные эффекты. Миграция нейтрофилов в очаги воспаления может привести к обширным локальным повреждениям вследствие выхода токсичного для тканей содержимого гранул нейтрофилов.
Дата добавления: 2015-07-07; просмотров: 2391;
