Зависимость теплового эффекта реакции от температуры. Закон Кирхгоффа
Влияние температуры на величины тепловых эффектов описывает закон Кирхгоффа:
Температурный коэффициент теплового эффекта химической реакции равен изменению теплоемкости системы в ходе реакции.
Продифференцируем ΔН и ΔU по температуре при постоянных давлении и температуре соответственно:
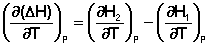 (I.22)
(I.22)
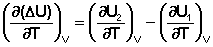 (I.23)
(I.23)
Производные энтальпии и внутренней энергии системы по температуре есть теплоемкости системы в изобарных и изохорных условиях Cp и Cv соответственно:
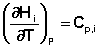 (I.24)
(I.24)
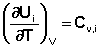 (I.25)
(I.25)
Подставив выражения (I.24, I.25) в (I.22, I.23), получаем математическую запись закона Кирхгоффа:
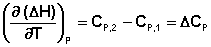 (I.26)
(I.26)
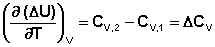 (I.27)
(I.27)
Для химического процесса изменение теплоемкости задается изменением состава системы и рассчитывается следующим образом:
 (I.28)
(I.28)
 (I.29)
(I.29)
Если проинтегрировать выражения (I.26, I.27) от Т = Т1 до Т = Т2, считая ΔСp (ΔСv) не зависящим от температуры, получим интегральную форму закона Кирхгоффа:
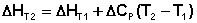 (I.30)
(I.30)
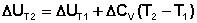 (I.31)
(I.31)
Поскольку обычно известны табличные значения стандартных тепловых эффектов ΔН°298 и ΔU°298, преобразуем выражения (I.30, I.31):
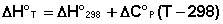 (I.32)
(I.32)
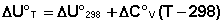 (I.33)
(I.33)
При расчете изменения теплового эффекта реакции в большом интервале температур необходимо учитывать зависимость теплоёмкости от температуры, которая выражается степенным рядом
C°P = aT + bT2 + cT3; коэффициенты a, b, c приведены в справочниках.
Дата добавления: 2015-08-08; просмотров: 735;
