Рабочее тело тепловых машин
2.1.1. Газ как рабочее тело
Выше было показано, что для непрерывного взаимного преобразования теплоты и работы необходимо иметь, кроме источника теплоты и теплоприемника, вспомогательное тело, которое воспринимает энергию в одной форме и в результате кругового процесса преобразует ее некоторую часть в другую форму. Это вспомогательное тело называют р а б о ч и мт е л о м.
В качестве рабочих тел тепловых машин необходимо использовать вещества, обладающие свойством сжимаемости. Это требование вытекает из того, что цикл тепловых машин обязательно включает в себя процессы, связанные с изменением объема рабочего тела, например, расширение продуктов сгорания в ДВС, сжатие фреона в компрессоре холодильной машины и т.п. В табл.3 и табл. 4 Приложения приведены свойства некоторых газов, используемых в качестве рабочих тел.
Рабочим телом современных теплоэнергетических установок являются однородный газ или газовые смеси. В ряде случаев протекание процессов связано с рабочим телом многофазового состава. Так, например, в испарителе холодильной машины хладагент находится в парожидкостном состоянии. Рабочее тело часто включает вещества, способные вступать друг с другом в химические реакции. В общем случае фазовые переходы и химические реакции сопровождаются тепловым и механическим взаимодействием с внешней средой, поэтому для их анализа используются общие методы термодинамики. Расчеты циклов энергетических установок существенно упрощаются, если реальный газ рассматривать как идеальный.
Под идеальным понимают газ, в котором силы межмолекулярного взаимодействия отсутствуют, а сами молекулы рассматриваются как материальные точки.
Все реальные газы при высоких температурах и малых давлениях почти полностью подходят под понятие идеального газа, и по своим свойствам практически не отличаются от него. Введение понятия идеального газа позволило получить простые математические зависимости между параметрами состояния и создать стройную теорию термодинамических процессов. Рассмотрим некоторые свойства газов и газовых смесей.
Уравнения состояния идеального газа
Функциональную связь между термодинамическими параметрами идеального газа впервые получил в 1834 г. французский физик Б. Клапейрон, использовавший при этом свойства газов, открытые англичанином Р. Бойлем и французом Ж. Гей-Люссаком.
Р. Бойль в 1662г. экспериментально установил следующую законо -мерность:
при одной и той же температуре удельный объем идеального газа изменяется обратно пропорционально изменению его давления, т.е.
p v = 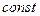 . (2.1)
. (2.1)
Независимо от Р.Бойля эту же закономерность в 1676 г. получил французский физик Э. Мариотт, поэтому выражение (2.1) именуют законом Бойля-Мариотта.
Ж. Гей-Люссак в 1802 г. опытным путем установил, что
при одном и том же давлении удельный объем идеального газа изменяется прямо пропорционально изменению его абсолютной температуры, т.е.
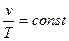 . ( 2.2)
. ( 2.2)
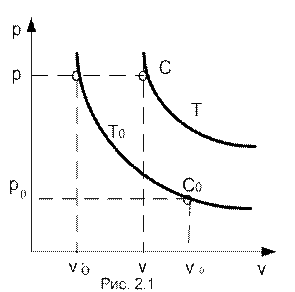
Рассмотрим два состояния 1 кг идеального газа. Первое состояние (С0) соответствует нормальным физическим условиям и характеризуется параметрами p0, v0, T0; второе состояние (C ) – произвольное, имеющее параметры p, v, T. Изобразим графически функцию (2.1) в координатах pv при температурах T0 = const и T = cоnst. Любая точка из полученных кривых изображает состояние газа, характеризуемое тремя конкретными параметрами (давлением, удельным объемом и температурой). Эти состояния изображены на рис. 2.1
Используя закономерность Бойля- Мариотта, выразим р через р0 и v0.
р v0′ = p0 v0, , (2.3)
 где v0' – удельный объем газа при давлении p и температуре T0.
где v0' – удельный объем газа при давлении p и температуре T0.
Из закона Гей-Люссака следует, что
v0′ /T0= v/T. (2.4)
Подставляя в (2.3) значение v0' из выражения (2.4), получим:
 . (2.5) Правая часть равенства (2.5) имеет для заданного газа конкретное численное значение, в термодинамике его обозначают R,т. е.
. (2.5) Правая часть равенства (2.5) имеет для заданного газа конкретное численное значение, в термодинамике его обозначают R,т. е. 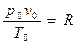 .
.
Величину R называют г а з о в о й п о с т о я н н о й и измеряют в Дж/(кг·К). Для произвольного состояния газа уравнение (2.5) будет иметь вид:
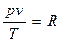 . (2.6)
. (2.6)
Выражение (2.6) называют уравнением Клапейрона. Оно устанавливает, что
для выбранного состояния произведение давления на удельный объем, деленное на абсолютную температуру, есть величина постоянная.
Найдем числовое значение газовой постоянной R и выявим ее физическую сущность. Для этого обратимся к еще одной закономерности поведе-
ния газов, экспериментально установленной в 1811г. итальянским ученым
А. Авогадро.
При одинаковых давлениях и температурах одинаковые количества различных газов занимают один и тот же объем.
В СИ за единицу количества вещества принят м о л ь (М). Моль равен количеству вещества системы, содержащей столько же структурных элементов, сколько содержится атомов в углероде – 12 массой 0,012 кг. Установлено, что в 12 г углерода содержится 6·1023 атомов. Такое количество структурных элементов в любом другом веществе имеет другую массу. Моль – расчетная единица и эталона для его воспроизведения не существует.
Массу одного моля вещества называют м о л я рн о й м а с с о й Молярную массу обозначают через μ. Единица молярной массы – кг/моль. При численном выражении молярной массы различных веществ иногда за единицу количества вещества принимают 1000 молей – 1 кмоль.
Величины, характеризующие количественную единицу вещества в молях, условимся обозначать чертой сверху. Тогда объем моля какого-либо газа 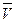 будет равен произведению удельного объема газа на его молярную массу, т.е.
будет равен произведению удельного объема газа на его молярную массу, т.е. 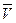 =
= 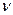 μ.
μ.
Согласно закону Авогадро, для различных газов при одинаковых условиях будет иметь:
v1 μ1 = v 2 μ 2 = v μ . (2.7)
Экспериментально установлено, что при нормальных физических условиях (T0 = 273,15; p0 = 760 мм рт. ст. = 101325 Па) объем одного моля любого газа 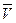 0 = 22,41 м3/моль.
0 = 22,41 м3/моль.
Из определения газовой постоянной следует, что
R = 
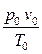 .
.
Умножив обе части этого равенства на μ и подставив численные значения p0,  и Т0, получим:
и Т0, получим:
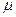 R
R 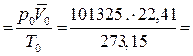 8314 Дж/(моль·К). Величину μR обозначают
8314 Дж/(моль·К). Величину μR обозначают 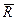 и называют у н и в е р с а л ь н о й (молярной)
и называют у н и в е р с а л ь н о й (молярной)
газовой постоянной.
Универсальная газовая постоянная для одного моля всех газов, независимо от их природы, является величиной постоянной и равной:
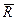 = 8314 Дж/(моль·К).
= 8314 Дж/(моль·К).
Отсюда, газовая постоянная 1 кг конкретного газа вычисляется как
R =  . (2.8)
. (2.8)
Для одного и того же газа, в зависимости от его массы, уравнение состояния может быть записано по-разному:
для 1 кг p v = R T, (2.9)
для m кг p V = m R Т , (2.10)
для одного моля p 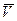 =
= 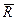 T.
T.  (2.11)
(2.11)
Чтобы уяснить физический смысл газовой постоянной, запишем уравнение (2.10) для одной и той же массы газа, находящейся в двух различных состояниях при одинаковом давлении:
р V1 = m R Т1 и p V2 = m R Т2 .
Вычитая из второго уравнения первое, получаем:
р (V2 –V1) = m R (T2 – T1),
откуда
R = 
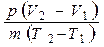 .
.
Числитель в полученном выражении представляет собой работу газа в процессе при постоянном давлении. Следовательно, если разность температур равна одному кельвину, а масса газа – одному килограмму, то газовая постоянная есть работа расширения 1 кг газа при увеличении его температуры на 1 кельвин в изобарном процессе.
Дата добавления: 2015-08-04; просмотров: 842;
