Электрокардиограмма 7 страница
Учитывая возможность тяжелых гипотензивных (в том числе ортостатических) реакций при приеме a1-адреноблокаторов, для лечения больных хроническим ЛС рекомендуют использовать минимальные суточные дозы этих препаратов. С этой целью лучше использовать новый высокоспецифичный a1-адреноблкатор доксазозин, который в отличие от празозина может приниматься 1 раз в сутки в дозе 0,5–2 мг. Помимо выраженного вазодилатирующего действия, доксазозин снижает агрегацию тромбоцитов и повышает фибринолитическую активность крови, а также благоприятно действует на липидный профиль, повышая содержание ЛВП и снижая ХС ЛНП и триглицериды.
Следует все же иметь в виду, что длительное применение у больных ЛС a1-адреноблокаторов в реальной клинической практике часто наталкивается на серьезные трудности, в основном из-за побочных эффектов этих препаратов. Лучшие результаты получают у больных с сопутствующей эссенциальной АГ.
Критически оценивая результаты лечения вазодилататорами больных хроническим ЛС, необходимо отметить следующее. Несмотря на то что при однократном применении этих препаратов в большинстве случаев удается достоверно снизить давление в легочной артерии, эффективность курсового назначения этих лекарственных средств все же существенно ниже, чем эффективность длительной низкопоточной оксигенотерапии и/или адекватного противовоспалительного лечения бронхолегочных заболеваний. Пока не получено убедительных доказательств того, что длительное лечение вазодилататорами увеличивает продолжительность и улучшает качество жизни больных хроническим ЛС.
Следует также помнить, что в отдельных случаях применение вазодилататоров может даже усугублять нарушения газообмена в легких. Например, эффективное снижение тонуса легочных артериол и увеличение кровотока в участках легких, пораженных воспалительным или фиброзирующим процессом, иногда может ухудшать вентиляционно-перфузионные соотношения в этих областях, особенно, если терапия вазодилататорами не подкрепляется адекватной коррекцией нарушений легочной вентиляции. Это приводит к усугублению артериальной гипоксемии и активирует механизм гипоксической легочной вазоконстрикции. В результате давление в легочной артерии может повыситься еще больше.
В некоторых случаях уменьшение легочного сосудистого сопротивления, наступающее под действием вазодилататоров, и снижение величины постнагрузки на ПЖ могут сопровождаться увеличением МО (естественно, при сохраненной систолической функции ПЖ), что является одним из факторов, способствующих повышению давления в легочной артерии. Этому способствует также рефлекторная тахикардия, развивающаяся при лечении некоторыми вазодилататорами. Наконец, следует также иметь в виду возможность критического падения системного АД под действием этих препаратов.
Таким образом, лечение антагонистами кальция, ингибиторами АПФ, нитратами и a1-адреноблокаторами больных хроническим ЛС следует проводить с большой осторожностью, желательно под контролем не только системного АД и ЧСС, но и давления в легочной артерии, ОЦК и функционального состояния легких. Применение этих лекарственных средств имеет смысл только на фоне адекватной коррекции нарушений легочной вентиляции и лечения бронхолегочных заболеваний.
 Запомните
1. У больных с хроническим ЛС с целью снижения легочного сосудистого сопротивления и давления в легочной артерии могут использоваться вазодилататоры: блокаторы медленных кальциевых каналов, ингибиторы АПФ, нитраты и a1-адреноблокаторы. 2. Применение вазодилататоров у больных с хроническим ЛС требует большой осторожности и адекватного контроля за гемодинамикой и функциональным состоянием легких, поскольку в некоторых случаях назначение этих лекарственных средств может ухудшить вентиляционно-перфузионные соотношения в легких, что способствует росту давления в легочной артерии. 3. Лечение вазодилататорами должно сопровождаться адекватной коррекцией нарушений легочной вентиляции и лечением бронхолегочных заболеваний (длительная оксигенотерапия, применение антибиотиков, бронхолитиков и т.п.). Без такой комплексной терапии длительное применение вазодилататоров у больных ХОБЛ и ЛС практически не влияет на продолжительность и качество жизни больных. Запомните
1. У больных с хроническим ЛС с целью снижения легочного сосудистого сопротивления и давления в легочной артерии могут использоваться вазодилататоры: блокаторы медленных кальциевых каналов, ингибиторы АПФ, нитраты и a1-адреноблокаторы. 2. Применение вазодилататоров у больных с хроническим ЛС требует большой осторожности и адекватного контроля за гемодинамикой и функциональным состоянием легких, поскольку в некоторых случаях назначение этих лекарственных средств может ухудшить вентиляционно-перфузионные соотношения в легких, что способствует росту давления в легочной артерии. 3. Лечение вазодилататорами должно сопровождаться адекватной коррекцией нарушений легочной вентиляции и лечением бронхолегочных заболеваний (длительная оксигенотерапия, применение антибиотиков, бронхолитиков и т.п.). Без такой комплексной терапии длительное применение вазодилататоров у больных ХОБЛ и ЛС практически не влияет на продолжительность и качество жизни больных.
|
Коррекция гемореологических нарушений и агрегации тромбоцитов
Повышение вязкости крови, агрегации тромбоцитов и свертываемости крови, характерное для больных хроническим ЛС, оказывает существенное влияние на легочное сосудистое сопротивление и прогноз. Кроме того, в тяжелых случаях эти нарушения ведут к развитию вторичных тромбозов мелких ветвей легочной артерии, что также способствует прогрессированию легочной АГ. Это оправдывает использование некоторых способов коррекции гемореологических нарушений и повышенной агрегации тромбоцитов, особенно у пациентов с высокими цифрами давления в легочной артерии. К числу таких методов относятся:
· Кровопускание по 200–300 мл крови. Оно показано при увеличении гематокрита больше 55–60% и высоком давлении в легочной артерии. Хотя однократное кровопускание на время улучшает состояние больного, повторные процедуры редко приводят к стабилизации уровня давления в легочной артерии.
· Низкомолекулярные гепарины. Лечение низкомолекулярными гепаринами (например, фраксипарином по 0,6 2 раза в сутки подкожно) в первую очередь показано больным ЛС, развившемся на фоне рецидивирующей тромбоэмболии мелких ветвей легочной артерии. В поддерживающих дозах фраксипарин может использоваться у больных ЛС до 3–6 месяцев. Менее эффективным оказывается назначение гепарина по 5000 ЕД 2 раза в день подкожно.
· Реополиглюкин внутривенно капельно по 200–400 мл 2 раза в неделю.
· Трентал внутрь по 100–400 мг 2–3 раза в день.
Особенности лечения правожелудочковой недостаточности
При развитии декомпенсированного ЛС с признаками правожелудочковой недостаточности применяют диуретики, ингибиторы АПФ и в некоторых случаях — сердечные гликозиды.
Диуретикипоказаны при появлении клинических признаков правожелудочковой недостаточности, в частности, при наличии отечного синдрома и высоких значений ОЦК. Обычно используют сильнодействующие петлевые диуретики (подробнее — см. главу 2). Эти препараты целесообразно сочетать с приемом калийсберегающих диуретиков или антагонистов альдостерона (альдактона, верошпирона и др.). Лечение начинают с малых суточных доз. Дозу препарата подбирают индивидуально. Медленное постепенное увеличение дозы мочегонных (“титрование дозы”) в большинстве случаев позволяет избежать резкого уменьшения ОЦК и снижения системного АД.
Следует также помнить, что неконтролируемое применение мощных диуретиков у больных ЛС может вызвать метаболический алкалоз, который способствует усугублению гиперкапнии. Последняя, как известно, снижает чувствительность дыхательного центра к СО2, что ведет к еще большему ухудшению легочной вентиляции и, как следствие, к возрастанию давления в легочной артерии.
Сердечные гликозиды. Необходимость применения этих лекарственных средств у больных декомпенсированным ЛС ограничена, прежде всего, случаями, осложненными фибрилляцией предсердий и сопутствующей левожелудочковой недостаточностью (например, у пациентов, страдающих ИБС). Используют, как правило, малые дозы гликозидов, например, дигоксин по 0,25 мг 1 раз в день.
В остальных случаях сердечные гликозиды у больных ЛС, как правило, малоэффективны, поскольку они не воздействуют на основной механизм развития легочной АГ — легочное сосудистое сопротивление. Мало того, увеличение под действием сердечных гликозидов ударного выброса ПЖ является фактором, повышающим уровень давления в легочной артерии. Следует также учитывать, что лечение сердечными гликозидами больных хроническим ЛС особенно часто сопровождается развитием гликозидной интоксикации и нарушениями сердечного ритма. Поэтому на длительный срок эти лекарственные средства больным, как правило, не назначаются.
Ингибиторы АПФ. Длительное применение этих лекарственных препаратов у больных с декомпенсированным ЛС в целом имеет большие преимущества перед другими способами лечения правожелудочковой недостаточности. Ингибиторы АПФ способны оказывать влияние не только на основные звенья патогенеза сердечной недостаточности, вызывая гемодинамическую и нейрогормональную “разгрузку” сердца, но и положительно влиять на уровень давления в легочной артерии (см. выше). Имеются сообщения о том, что длительное применение ингибиторов АПФ у больных декомпенсированным ЛС сопровождается замедлением прогрессирования сердечной недостаточности, снижением летальности, улучшением прогноза и качества жизни больных.
Механизмы положительного влияния ингибиторов АПФ на состояние больных с сердечной недостаточностью подробно обсуждались в главе 2. Напомним, что эффективность применения этих препаратов при сердечной декомпенсации связана, прежде всего, с устранением активации тканевых РАС и выражается в следующих положительных реакциях:
· замедление процессов ремоделирования сердца, сосудов и других органов;
· обратное развитие гипертрофии миокарда желудочков;
· предотвращение прогрессирования дилатации ПЖ;
· замедление формирования интерстициального фиброза миокарда;
· снижение диастолической ригидности ПЖ.
Кроме того, ингибиторы АПФ, воздействуя на гуморальную (эндокринную) РААС и угнетая образование циркулирующего ангиотензина II, способствуют выраженной гемодинамической разгрузке сердца и снижению величины пред- и постнагрузки на ПЖ. Эти эффекты ингибиторов АПФ обеспечиваются:
· системной вазодилатацией артериол (уменьшение постнагрузки) и вен (уменьшение преднагрузки);
· уменьшением синтеза альдостерона в надпочечниках и снижением реабсорбции Nа+ и воды в дистальных канальцах почек (снижение ОЦК и величины преднагрузки);
· уменьшением активности САС.
Применение ингибиторов АПФ у больных декомпенсированным ЛС требует соблюдения тех же принципов лечения, рекомендованных Европейским обществом кардиологов (1997), которые были изложены в главе 2. Для лечения используют современные препараты II и III поколений, начальные и поддерживающие дозы которых представлены в табл. 13.2.
Таблица 13.2
Начальная и поддерживающая дозы ингибиторов АПФ при лечении больных декомпенсированным легочным сердцем
| Препарат | Начальная доза, мг в сутки | Поддерживающая доза, мг в сутки |
| Беназеприл | 2,5 | до 5–10 |
| Каптоприл | 18,75 (в 3 приема) | до 50–75 (в 3 приема) |
| Эналаприл | 2,5 | до 10–20 (в 2 приема) |
| Лизиноприл | 2,5 | до 5–20 (1 раз в сутки) |
| Квинаприл | 2,5–5 | до 10–20 (в 2 приема) |
| Периндоприл | ||
| Рамиприл | 1,25–2,5 | 2,5–5 |
При длительном лечении ингибиторами АПФ необходимо также учитывать возможные побочные эффекты этих препаратов и соблюдать описанные ранее меры предосторожности (см. главу 2).
Таким образом, комплексное лечение больных хроническим ЛС должно предусматривать адекватную терапию основного заболевания, коррекцию легочной артериальной гипоксемии, воздействие на гемореологические показатели, агрегацию тромбоцитов и свертываемость крови, гемодинамическую и нейрогормональную “разгрузку” сердца и острожное применение вазодилататоров, снижающих давление в легочной артерии.
Прогноз
Прогноз в большинстве случаев зависит от характера и тяжести основного заболевания бронхолегочной системы. Наиболее серьезный прогноз имеют пациенты с первичной легочной АГ и рецидивирующими тромбоэмболиями мелких ветвей легочной артерии. Продолжительность жизни больных декомпенсированным ЛС с признаками прогрессирующей правожелудочковой недостаточности и отечным синдромом обычно не превышает 2,5–5 лет.
| Глава 14. Тромбоэмболия легочной артерии и острое легочное сердце |

|
Тромбоэмболия легочной артерии (ТЭЛА) — это окклюзия просвета основного ствола или ветвей легочной артерии частичками тромба, сформировавшегося в венах большого круга кровообращения или полостях правого сердца, переносимыми в малый круг кровообращения с током крови. Механическая закупорка ствола или ветвей легочной артерии тромбоэмболом сопровождается генерализованным спазмом легочных артериол, что приводит к резкому ограничению кровотока в легких.
ТЭЛА — распространенное и прогностически весьма неблагоприятное осложнение различных заболеваний, травм и оперативных вмешательств. ТЭЛА занимает третье место среди причин смерти населения (после других сердечно-сосудистых заболеваний и злокачественных новообразований). На аутопсии ее выявляют в 7–10% случаев всех патологоанатомических вскрытий. Причем легочная тромбоэмолия при жизни не диагностируется более чем у 1/2 больных. Летальность при возникновении ТЭЛА составляет около 30%, хотя на фоне адекватной и своевременно начатой терапии она снижается до 10%.
| 14.1. Этиология |

|
Наиболее частой причиной ТЭЛА является острый тромбоз глубоких вен илеофеморального сегмента. Гораздо реже источником ТЭЛА служат тромбозы глубоких вен голеней. К относительно редким причинам ТЭЛА относятся тромбозы венозных сплетений таза, пристеночные тромбы в полостях правого сердца. Тромбофлебиты поверхностных вен почти никогда не осложняются ТЭЛА.
Следует отметить, что ТЭЛА развивается не во всех случаях острого тромбоза глубоких вен. Например у больных с тромбозами илеофеморальных вен ТЭЛА возникает в половине случаев, а при тромбозе глубоких вен голеней — только в 1–5% случаев. Отрываются и переносятся с током крови в малый круг кровообращения главным образом так называемые флотирующие тромбы, имеющие единственную точку фиксации в своем дистальном отделе. Длина таких тромбов достигает иногда 15–20 см. При тромбах, окклюзирующих просвет сосуда, ТЭЛА не развивается.
В таблице 14.1 перечислены основные факторы, способствующие возникновению тромбоза магистральных вен и, соответственно, ТЭЛА. В первую очередь к ним относятся злокачественные новообразования (около 30% случаев ТЭЛА), которые, как известно, сопровождаются синдромом гиперкоагуляции и угнетением системы фибринолиза.
Одним из ведущих факторов, способствующих тромбообразованию в глубоких венах нижних конечностей, является гиподинамия. Значительное уменьшение работы мышц нижних конечностей приводит к замедлению кровотока в венах, что способствует образованию там тромбов. Особенно опасна гиподинамия у лиц пожилого и старческого возраста, у больных, вынужденных соблюдать постельный режим (ИМ, инсульт, ХСН, переломы костей и т.п.) или страдающих хронической венозной недостаточностью нижних конечностей. Нередко ТЭЛА осложняет течение послеоперационного периода (операции на матке, яичниках, предстательной железе, мочевом пузыре, желудке, толстой кишке и т.д.), особенно если имеются гнойные осложнения этих операций.
Таблица 14.1
Факторы, способствующие возникновению тромбоза глубоких вен нижних конечностей
| Злокачественные новообразования |
| Гиподинамия, в том числе необходимость соблюдения постельного режима |
| Переломы костей или травмы ног |
| Хирургические вмешательства, в первую очередь на органах брюшной полости и нижних конечностях |
| Пожилой и старческий возраст |
| Хроническая сердечная недостаточность |
| Ожирение |
| Сахарный диабет |
| Прием пероральных контрацептивов |
| Хроническая венозная недостаточность нижних конечностей |
| Первичные гиперкоагуляционные состояния |
| Эритремия |
| Системная красная волчанка |
| Наследственные факторы (дефицит антитромбина III, протеинов С и S, дисфибриногенемия, гомоцистеинурия и др.) |
 Запомните
1. Около 70% случаев ТЭЛА связаны с наличием флотирующего тромба в глубоких венах илеофеморального сегмента. Тромбофлебит поверхностных вен почти никогда не сопровождается ТЭЛА. 2. К числу наиболее распространенных факторов, способствующих тромбообразованию в магистральных венах, относятся: Запомните
1. Около 70% случаев ТЭЛА связаны с наличием флотирующего тромба в глубоких венах илеофеморального сегмента. Тромбофлебит поверхностных вен почти никогда не сопровождается ТЭЛА. 2. К числу наиболее распространенных факторов, способствующих тромбообразованию в магистральных венах, относятся:
|
14.2. Патогенез
| 14.2.1. Механизмы обструкции легочно-артериального русла |

|
Патогенез гемодинамических и вентиляционных расстройств при ТЭЛА чрезвычайно сложен (рис. 14.1). Ведущим фактором в генезе гемодинамических расстройств при ТЭЛА является механическая обструкция легочно-артериального русла. Причем тромб, оторвавшийся от места своего образования, например в глубоких венах нижних конечностей, и переносимый с током крови в малый круг кровообращения, частично разрушается. Поэтому в большинстве случаев имеет место множественная окклюзия нескольких ветвей легочной артерии разного калибра, часто двусторонняя (немассивная ТЭЛА). В более редких случаях происходит массивная тромбоэмболия главных ветвей или ствола легочной артерии, которая, как правило, сопровождается острым (без предвестников) развитием тяжелейшей клинической картины тромбоэмболии, в том числе быстро наступающей внезапной сердечной смертью. При субмассивной ТЭЛА эмболизируются долевые и сегментарные ветви легочной артерии.
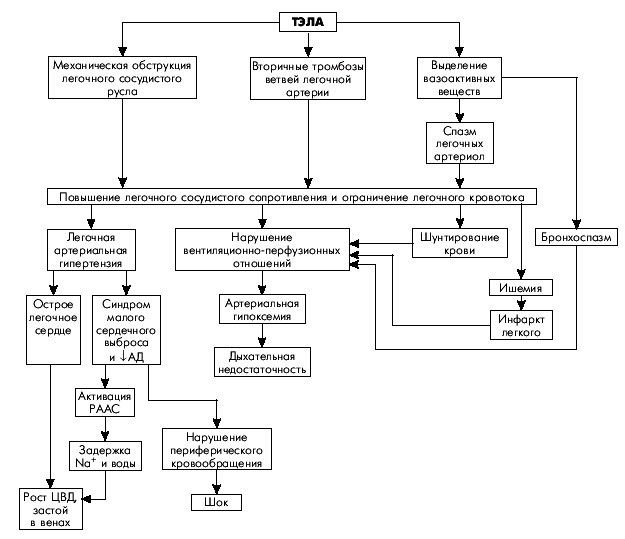
|
| Рис. 14.1. Схема патогенеза острого легочного сердца при тромбоэмболии легочной артерии |
Наряду с механической частичной или полной закупоркой легочно-артериального русла тромбоэмболом происходит резко выраженный генерализованный спазм артериол малого круга, во многом обусловленный высвобождением из тромбоцитов, оседающих на поверхности тромбоэмбола, вазоконстрикторных субстанций (тромбоксана А2, серотонина, гистамина и др.). В результате легочное сосудистое сопротивление возрастает в еще большей степени. Это объясняет частое несоответствие между объемом эмболической окклюзии легочных сосудов и тяжестью клинической картины ТЭЛА.
Следует также помнить, что при ТЭЛА степень окклюзии просвета сосуда со временем может увеличиваться за счет присоединения вторичного местного тромбоза, который увеличивает размеры тромбоэмбола в проксимальном направлении, т.е. против тока крови. Нередко это приводит к трансформации немассивной ТЭЛА в массивную (рис. 14.2).
 Запомните
Ведущим фактором, определяющим степень гемодинамических расстройств и нарушения вентиляционно-перфузионных соотношений при ТЭЛА, является обструкция легочно-артериального русла, степень которой зависит от: Запомните
Ведущим фактором, определяющим степень гемодинамических расстройств и нарушения вентиляционно-перфузионных соотношений при ТЭЛА, является обструкция легочно-артериального русла, степень которой зависит от:
|
| Рис. 14.2. Увеличение окклюзии ветви легочной артерии за счет вторичного тромбозирования эмбола. а — первоначальная эмболия одной из мелких ветвей ЛА; б — образование вторичного местного тромба, увеличивающего размеры обструкции ветвей ЛА | 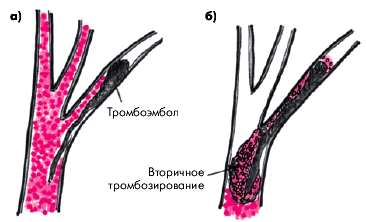
| ||
| 14.2.2. Гемодинамические последствия тромбоэмболии легочной артерии | |||

| |||
Полное или частичное прекращение легочного кровотока в результате тромбоэмболии легочной артерии приводит к двум основным следствиям, определяющим клиническую картину заболевания и судьбу больного (рис. 14.3):
1. Выраженному нарушению вентиляционно-перфузионных отношений, что приводит к возникновению дыхательной недостаточности и артериальной гипоксемии.
2. Формированию легочной артериальной гипертензии, которая, в свою очередь, является причиной резкого падения МО и системного АД, а также к развитию острой правожелудочковой недостаточности (острого легочного сердца).
Дыхательная недостаточность и артериальная гипоксемия возникают, прежде всего, в результате прекращения кровотока в хорошо вентилируемых альвеолах, что приводит к увеличению внутрилегочного “мертвого пространства” и ухудшению газообмена. Нарушение вентиляционно-перфузионных отношений усугубляется выраженным бронхоспазмом, связанным с действием на гладкую мускулатуру мелких бронхов биологически активных веществ, выделяющихся из тромбоцитов (тромбоксан А2, серотонин и др.). Кроме того, в результате ишемии альвеол, обусловленной их недостаточной перфузией, нарушается не только их вентиляция, но и выработка сурфактанта, что уже спустя 1–2 суток после тромбоэмболии может привести к развитию ателектазов. Вследствие недостаточности кровоснабжения альвеол может развиться инфаркт легкого. Кроме того, снижение вентиляции хорошо перфузируемых альвеол еще больше нарушает газообмен в легких и приводит к усугублению артериальной гипоксемии. Наконец, в результате повышения давления проксимальнее области окклюзии открываются артериоло-венозные анастомозы и происходит шунтирование крови из артериол в вены, что также усугубляет артериальную гипоксемию.
Вторым следствием окклюзии ветвей легочной артерии является легочная АГ. Она обусловлена как самой механической окклюзией сосудистого русла тромбоэмболом, так и генерализованным спазмом легочных артериол. В результате повышается легочное сосудистое сопротивление на фоне значительного уменьшения емкости артериального русла. Это приводит к значительному ограничению венозного притока крови в левые отделы сердца и развитию синдрома малого сердечного выброса: уменьшаются МО, СИ, уровень АД, нарушается кровоснабжение жизненно важных органов (головного мозга, сердца, почек). В тяжелых случаях могут развиться признаки так называемого обструктивного шока, включая потерю сознания (синкопе), значительное снижение АД, уменьшение диуреза, стенокардию и т.д.
| Рис. 14.3. Схема гемодинамических расстройств при тромбоэмболии легочной артерии | 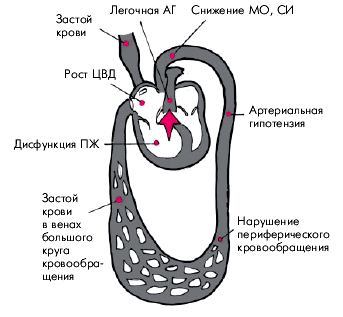
|
Кроме того, значительные цифры давления в легочной артерии и увеличение постнагрузки на ПЖ может приводить к быстрому развитию острого легочного сердца. Повышается систолическое и конечно-диастолическое давление в ПЖ, ПП, желудочек и предсердие дилатируются и возникает застой крови в венозном русле большого круга кровообращения.
 Запомните
Для острой ТЭЛА характерно два нарушения гемодинамики и альвеолярной вентиляции: 1. Дыхательная недостаточность и артериальная гипоксемия, причинами которых являются:
· прекращение кровотока по вентилируемым альвеолам, что приводит к увеличению внутрилегочного “мертвого пространства”;
· бронхоспазм;
· развитие ателектазов;
· ишемия легкого и снижение вентиляции;
· артериоло-венозное шунтирование крови.
2. Легочная АГ, возникающая в результате механической окклюзии сосудистого русла и генерализованного спазма артериол. Следствием повышенного давления в легочной артерии являются:
· синдром малого сердечного выброса, сопровождающийся снижением МО, АД и нарушением кровоснабжения жизненно важных органов (головного мозга, сердца, почек);
· острая правожелудочковая недостаточность с подъемом КДД ПЖ, ЦВД и (в тяжелых случаях) застоем крови в венах большого круга кровообращения. Запомните
Для острой ТЭЛА характерно два нарушения гемодинамики и альвеолярной вентиляции: 1. Дыхательная недостаточность и артериальная гипоксемия, причинами которых являются:
· прекращение кровотока по вентилируемым альвеолам, что приводит к увеличению внутрилегочного “мертвого пространства”;
· бронхоспазм;
· развитие ателектазов;
· ишемия легкого и снижение вентиляции;
· артериоло-венозное шунтирование крови.
2. Легочная АГ, возникающая в результате механической окклюзии сосудистого русла и генерализованного спазма артериол. Следствием повышенного давления в легочной артерии являются:
· синдром малого сердечного выброса, сопровождающийся снижением МО, АД и нарушением кровоснабжения жизненно важных органов (головного мозга, сердца, почек);
· острая правожелудочковая недостаточность с подъемом КДД ПЖ, ЦВД и (в тяжелых случаях) застоем крови в венах большого круга кровообращения.
|
Следует подчеркнуть, что далеко не всегда при ТЭЛА присутствуют все описанные нарушения гемодинамики и альвеолярной вентиляции. Это зависит прежде всего от массивности тромбоэмболии, а также от локализации тромбоэмбола. Наиболее яркие клинические проявления ТЭЛА возникают, когда острое ограничение легочного кровотока достигает 60% от объема всего сосудистого русла легких.
| 14.3. Клиническая картина |

|
Клиническая картина заболевания определяется объемом эмболизации легочного сосудистого русла, локализацией тромбоэмбола, уровнем легочной АГ, степенью гемодинамических расстройств и другими факторами.
С практической точки зрения очень удобно деление ТЭЛА на два варианта:
- массивную и субмассивную ТЭЛА;
- немассивную ТЭЛА.
Массивная и субмассивная ТЭЛА обусловлена тотальной или субтотальной окклюзией крупной проксимальной ветви или ствола легочной артерии; протекает остро, с бурной клинической симптоматикой и часто заканчивается внезапной смертью. Считают, что в отдельных случаях массивная ТЭЛА может развиться в результате распространенной множественной эмболии более мелких ветвей легочной артерии вследствие предшествующих изменений в легких. Немассивная ТЭЛА связана с эмболией мелких ветвей легочной артерии.
| 14.3.1. Массивная и субмассивная ТЭЛА |

|
Клиническая картина тромбоэмболии ствола или крупных ветвей легочной артерии в большинстве случаев характеризуется острым началом заболевания, бурным прогрессированием симптомов эмболии, развитием дыхательной и правожелудочковой недостаточности, падением АД и нарушением перфузии внутренних органов.
 Запомните
Массивная и субмассивная ТЭЛА, если она не приводит к быстрому летальному исходу, может сопровождаться развитием нескольких синдромов:
· дыхательной недостаточности;
· инфаркта легкого или инфарктной пневмонии;
· плеврита (сухого или экссудативного, в том числе геморрагического);
· острого легочного сердца;
· артериальной гипотонии;
· нарушением перфузии внутренних органов. Запомните
Массивная и субмассивная ТЭЛА, если она не приводит к быстрому летальному исходу, может сопровождаться развитием нескольких синдромов:
· дыхательной недостаточности;
· инфаркта легкого или инфарктной пневмонии;
· плеврита (сухого или экссудативного, в том числе геморрагического);
· острого легочного сердца;
· артериальной гипотонии;
· нарушением перфузии внутренних органов.
|
Жалобы
Массивная ТЭЛА, как правило, начинается с внезапного появления “необъяснимой” одышки в покое. Число дыхательных движений увеличивается до 20–30 в мин и более. Столь же часто (примерно в 85–90% случаев) появляются боли в грудной клетке. Они чаще локализуются за грудиной, напоминая ангинозные боли при ИМ. Нередко боли носят характер острых плевральных болей, усиливающихся при дыхании, кашле и обусловленных развитием инфаркта легкого, инфарктной пневмонии или сухого плеврита. Реже боли локализуются в правом подреберье и сопровождаются вздутием живота (парез кишечника) и упорной икотой, свидетельствуя, как правило, о поражении диафрагмальной плевры. У половины больных при этом возникает непродуктивный кашель. Только в  случаев инфаркта легкого появляется кровохарканье, обычно в виде прожилок крови в мокроте. Примерно в 45–50% случаев отмечается повышение температуры тела выше 37° С, которое обусловлено преимущественно развитием воспалительного процесса в легких и плевре.
случаев инфаркта легкого появляется кровохарканье, обычно в виде прожилок крови в мокроте. Примерно в 45–50% случаев отмечается повышение температуры тела выше 37° С, которое обусловлено преимущественно развитием воспалительного процесса в легких и плевре.
У половины больных с массивной ТЭЛА наблюдаются падение АД, коллапс и разнообразные церебральные расстройства (головокружения, кратковременная потеря сознания, выраженная адинамия или, наоборот, возбуждение, непроизвольное мочеиспускание или дефекация, судороги в конечностях и т.д.).
Физикальное исследование
Массивная ТЭЛА сопровождается появлением цианоза, который часто сочетается с бледностью кожных покровов, обусловленной падением АД и нарушением периферического кровообращения (спазм периферических сосудов в ответ на резкое снижение сердечного выброса). Сочетание цианоза и бледности придает кожным покровам своеобразный пепельный оттенок. В некоторых случаях появляется выраженный “чугунный” цианоз лица, области шеи и верхней половины туловища.
Дата добавления: 2015-08-04; просмотров: 1009;
