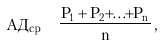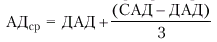Функция сократимости 2 страница
Диастолическая функция сердца
Диастолическая функция сердца — это способность желудочков во время диастолы вместить необходимый объем крови (КДО), поступающей в них из предсердий. Диастолическая функция определяется:
- скоростью активного расслабления миокарда желудочков, зависящей, прежде всего, от эффективности механизмов удаления ионов Са2+ из кардиомиоцитов;
- степенью податливости стенки желудочка, которая, в свою очередь, зависит от величины мышечной массы желудочка, наличия в сердечной мышце участков фиброза, ишемии, некроза или воспаления, от эластичности листков перикарда и т.п.;
- эффективностью сокращений предсердий.
Диастолическая функция желудочков самым тесным образом связана с величиной преднагрузки. Податливый желудочек легко заполняется кровью, что способствует нормальному растяжению мышечных волокон и последующему адекватному сокращению. Наоборот, «жесткий» желудочек не в состоянии принять необходимый объем крови. В этих случаях, для того чтобы достичь нормального растяжения мышечных волокон и обеспечить должную преднагрузку, необходимо более высокое, чем в норме, давление наполнения. В результате повышается КДД в желудочке, что способствует сохранению до поры до времени нормальной величины КДО и сердечного выброса (рис. 1.31). Важным следствием уменьшения податливости желудочка является также компенсаторное увеличение силы сокращения предсердия, которое интенсивно выталкивает в конце диастолы последний объем крови, заполняющий желудочек, увеличивая преднагрузку и, соответственно, сохраняя нормальный УО и сердечный выброс. При мерцательной аритмии, когда отсутствует единое сокращение предсердий, происходит значительное снижение преднагрузки, УО и сердечного выброса. Последний показатель в результате этого может снижаться на 15–25%.
| Рис. 1.31. Изменение давления наполнения желудочка при его диастолической дисфункции. а — в норме податливый желудочек легко заполняется кровью при нормальном давлении наполнения; б — «жесткий» желудочек при нормальной величине давления наполнения не растягивается в диастолу в достаточной степени; в — нормальное растяжение «жесткого» желудочка возможно только при повышении давления наполнения | 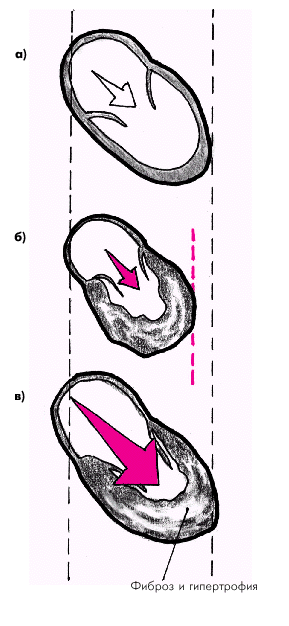
|
Таким образом, главными показателями диастолической функции желудочков являются:
· скорость активного диастолического расслабления желудочка (оценивается по продолжительности фазы изоволюмического расслабления);
· структура диастолического наполнения желудочка (оценивается по результатам допплер-эхокардиографического исследования трансмитрального или транстрикуспидального потока крови);
· уровень конечно-диастолического давления (КДД) в желудочке и среднего давления в предсердии;
· эффективность сокращений предсердий.
При нарушении диастолической функции ЛЖ происходит увеличение времени его изоволюмического расслабления, изменение структуры диастолического наполнения и возрастает КДД в ЛЖ и среднее давление в ЛП. При этом показатели систолической функции ЛЖ (МО, СИ, ФВ, УО, УИ и др.) остаются нормальными или малоизмененными. Отсутствует также дилатация желудочка (нормальные значения КДО).
 Запомните
1. Основными показателями, характеризующими систолическую функцию сердца, являются величины сердечного выброса (МО), сердечного индекса (СИ), фракции выброса (ФВ), ударного объема (УО) и ударного индекса (УИ). Уменьшение этих показателей и возрастание КДД в желудочке свидетельствует о снижении систолической функции (при условии одновременного увеличения КДО и/или КСО желудочка). 2. Величина сердечного выброса и других показателей систолической функции определяется тремя основными факторами: величиной преднагрузки; инотропным состоянием (сократимостью) миокарда; величиной постнагрузки. 3. Главными показателями диастолической функции желудочков являются: · продолжительность фазы изоволюмического расслабления; · структура диастолического наполнения желудочка (по данным допплер–ЭхоКГ); · уровень КДД в желудочке и среднего давления в предсердии. 4. Увеличение КДД в желудочке, давления в предсердии, продолжительности фазы изоволюмического расслабления, а также изменение структуры диастолического наполнения желудочка при малоизмененных показателях его систолической функции и нормальном КДО указывает на наличие диастолической дисфункции желудочка. Запомните
1. Основными показателями, характеризующими систолическую функцию сердца, являются величины сердечного выброса (МО), сердечного индекса (СИ), фракции выброса (ФВ), ударного объема (УО) и ударного индекса (УИ). Уменьшение этих показателей и возрастание КДД в желудочке свидетельствует о снижении систолической функции (при условии одновременного увеличения КДО и/или КСО желудочка). 2. Величина сердечного выброса и других показателей систолической функции определяется тремя основными факторами: величиной преднагрузки; инотропным состоянием (сократимостью) миокарда; величиной постнагрузки. 3. Главными показателями диастолической функции желудочков являются: · продолжительность фазы изоволюмического расслабления; · структура диастолического наполнения желудочка (по данным допплер–ЭхоКГ); · уровень КДД в желудочке и среднего давления в предсердии. 4. Увеличение КДД в желудочке, давления в предсердии, продолжительности фазы изоволюмического расслабления, а также изменение структуры диастолического наполнения желудочка при малоизмененных показателях его систолической функции и нормальном КДО указывает на наличие диастолической дисфункции желудочка.
|
| 1.1.4. Регуляция функций сердца |

|
|
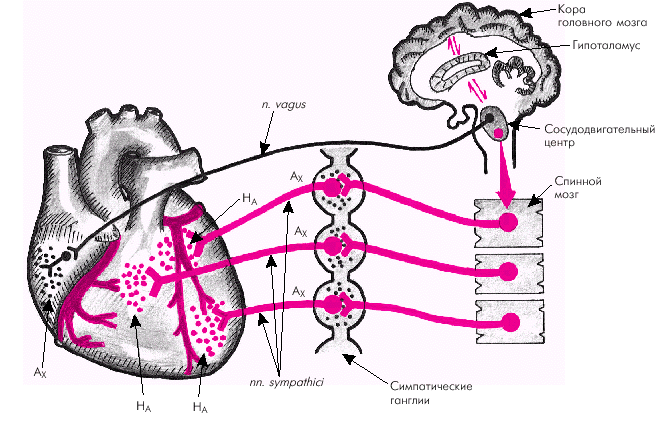
| Рис. 1.32. Нервно-гуморальная регуляция сердца (по А.В. Коробкову и С.А. Чесноковой, 1986). А Х — ацетилхолин; Н А — норадреналин |
a- и b-адренорецепторы, впервые описанные в 1948 г. R.P. Ahlquist, представляют собой два функционально различных типа рецепторов. Их стимуляция норадреналином (НА), выделяющимся из окончаний симпатических нервов, или адреналином (А), образующимся в надпочечниках и доставляемым к клеткам-мишеням с током крови, «запускает» различные генетически запрограммированные внутриклеточные процессы. Конечный эффект симпатической стимуляции зависит, главным образом, от соотношения в клетках тех или иных органов и тканей a- и b-адренорецепторов.
В табл. 1.2 перечислены важнейшие эффекты стимуляции a- и b-адренорецепторов.
Таблица 1.2
Важнейшие эффекты стимуляции адренорецепторов
| Тип рецептора | Механизм | Медиатор | Локализация | Эффекты |
| b1 | Активация аденилатциклазы и цАМФ | НА А | Рабочий миокард | Положит. инотропный |
| Миокард предсердий | Положит. инотропный | |||
| СА-узел | Положит. хронотропный (увеличение автоматизма СА-узла) | |||
| АВ-узел | Положит. дромотропный Положит.хронотропный | |||
| Система Гиса–Пуркинье | То же | |||
| b2 | Активация аденилатциклазы | А | Бронхи | Расширение |
| Сосуды: коронарные, скелетн.мышц, орг-в брюшн.пол., легочной артерии | Расширение | |||
| Крупные вены | Расширение | |||
| Скелетные мышцы | Активация гликогенолиза | |||
| Печень | Активация гликогенолиза | |||
| Поджелудочная железа | Повышение секреции инсулина | |||
| Миометрий | Расслабление | |||
| a1 | Активация фосфолипидного пути (Са2+-протеинкиназа С) | НА А | Артериолы | Сужение |
| Вены | Сужение | |||
| Миокард желудочков | Положит. инотропный, Гипертрофия миокарда (при длительном воздействии) | |||
| a2 | Ингибирование аденилатциклазы | А | Внесинаптические окончания в сосудах | Сужение сосудов |
| НА | Пресинаптические окончания симпатич. волокон сосудов | Расширение сосудов | ||
| Активация фосфолипидного пути | А | Тромбоциты | Агрегация тромбоцитов |
В сердце, как известно, преобладают b1-адренорецепторы, стимуляция которых сопровождается положительным инотропным, хронотропным и дромотропным эффектами. В результате повышается сократимость миокарда, увеличивается ЧСС (положительный хронотропный эффект), сила и скорость сокращения предсердий и желудочков (положительный инотропный эффект), скорость расслабления миокарда, ускоряется проведение электрического импульса в атриовентрикулярном узле (положительный дромотропный эффект), увеличивается возбудимость сердечной мышцы (батмотропный эффект).
Стимуляция a1-рецепторов, также присутствующих в миокарде (хотя и в меньшем количестве), сопровождается положительным инотропным эффектом. Кроме того, длительное воздействие медиаторов на a1-адренорецепторы кардиомиоцитов ведет к постепенному развитию гипертрофии сердечной мышцы.
На рис. 1.33 показано, что чрезмерно высокая концентрация норадреналина в синапсах стимулирует a2-адренорецепторы, расположенные в пресинаптических окончаниях симпатических нервов, иннервирующих сосуды, что ведет к ингибированию высвобождения норадреналина. Наоборот, воздействие норадреналина на пресинаптические b2-рецепторы активирует высвобождение этого медиатора из нервных окончаний симпатических нервов.
Возбуждение парасимпатических нервов (n. vagi) сопровождается высвобождением медиатора ацетилхолина (АX), который взаимодействует с М-холинорецепторами клеток-мишеней, вызывая урежение сердечных сокращений (отрицательный хронотропный эффект), замедление проводимости по атриовентрикулярному узлу вплоть до полной блокады проведения (отрицательный дромотропный эффект), уменьшение силы и скорости сокращения (отрицательный инотропный эффект). Интересно, что ацетилхолин, освобождаемый из нервных окончаний парасимпатических волокон способен стимулировать М-холинорецепторы, расположенные на окончаниях симпатических волокон, что приводит к угнетению освобождения из них норадреналина (см. рис. 1.33).

|
| Рис. 1.33. Симпатическая и парасимпатическая иннервация кардиомиоцита и действие медиаторов на рецепторы. Красными стрелками обозначена стимуляция адренергических рецепторов катехоламинами, черными — стимуляция М-холинрецепторов ацетилхолином, а также угнетение высвобождения На симпатическим нервом |
В табл. 1.3 представлены основные эффекты стимуляции М-холинорецепторов.
Таблица 1.3
Важнейшие эффекты стимуляции М-холинорецепторов
| Локализация | Эффекты | Механизмы |
| СА-узел | Отрицательный хронотропный | Уменьшение автоматизма Гиперполяризация клеточных мембран Снижение скорости диастолической деполяризации |
| АВ-узел | Отрицательный дромотропный | Замедление проводимости (увеличение А-Н-интервала) Увеличение рефрактерного периода |
| Миокард предсердий | Отрицательный инотропный | Укорочение длительности ТМПД Гиперполяризация мембран Укорочение рефрактерного периода |
| Волокна Пуркинье | Отрицательный дромотропный | Замедление проведения Повышение автоматизма |
| Миокард желудочков | Отрицательный инотропный Дисперсия реполяризации желудочков | Удлинение рефрактерного периода |
| Артериолы | Релаксация | Неизвестен (возможно, стимуляция эндотелиальных факторов расслабления) |
 Запомните
1. Стимуляция b1-адренорецепторов сопровождается увеличением сократимости миокарда предсердий и желудочков, ЧСС, скорости расслабления миокарда, ускорением проведения электрического импульса в АВ-узле, увеличением возбудимости сердечной мышцы. 2. Возбуждение a1-адренорецепторов также сопровождается положительным инотропным эффектом и, кроме того, при длительной активации симпатической нервной системы способствует постепенному формированию гипертрофии сердечной мышцы. 3. Стимуляция М-холинорецепторов (парасимпатическая нервная система) вызывает урежение сердечных сокращений, замедление проводимости по АВ-узлу, уменьшение силы и скорости сокращения сердечной мышцы. Следует помнить также, что симпатические и парасимпатические влияния на сердце регулируются сердечными центрами продолговатого мозга и моста, корой головного мозга и гипоталамусом. Запомните
1. Стимуляция b1-адренорецепторов сопровождается увеличением сократимости миокарда предсердий и желудочков, ЧСС, скорости расслабления миокарда, ускорением проведения электрического импульса в АВ-узле, увеличением возбудимости сердечной мышцы. 2. Возбуждение a1-адренорецепторов также сопровождается положительным инотропным эффектом и, кроме того, при длительной активации симпатической нервной системы способствует постепенному формированию гипертрофии сердечной мышцы. 3. Стимуляция М-холинорецепторов (парасимпатическая нервная система) вызывает урежение сердечных сокращений, замедление проводимости по АВ-узлу, уменьшение силы и скорости сокращения сердечной мышцы. Следует помнить также, что симпатические и парасимпатические влияния на сердце регулируются сердечными центрами продолговатого мозга и моста, корой головного мозга и гипоталамусом.
|
| 1.2. Сосудистая система |

|
| |||||
Примерно 84% общего объема крови сосредоточено в большом круге кровообращения; а еще около 16% — в малом круге и сердце. Сосудистая система представлена амортизирующими, резистивными, емкостными сосудами и капиллярами.
К амортизирующим сосудам относятся артерии эластического типа — аорта, легочная артерия и прилегающие к ним участки крупных артерий. Их стенка содержит большое количество эластических волокон, что позволяет амортизировать (сглаживать) значительные колебания артериального давления (АД), обусловленные систолическим выбросом крови в аорту и легочную артерию (эффект компрессионной камеры).
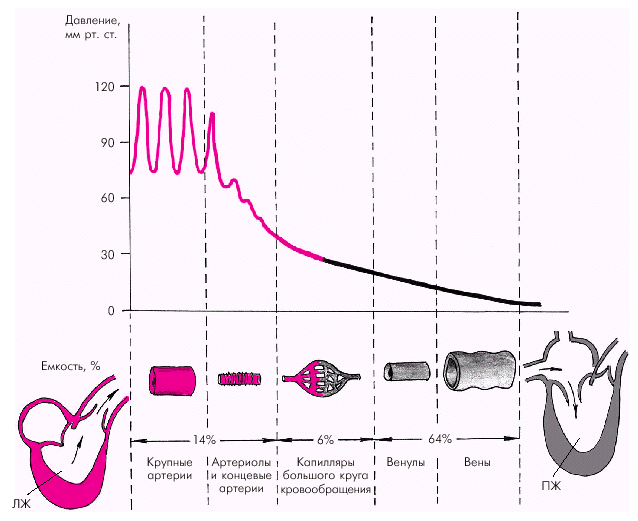
Резистивные сосуды (преимущественно концевые артерии и артериолы) характеризуются относительно малым просветом и толстыми гладкомышечными стенками. На их долю приходится около 50% общего сосудистого сопротивления кровотоку, хотя общая емкость их сравнительно невелика (рис. 1.34).
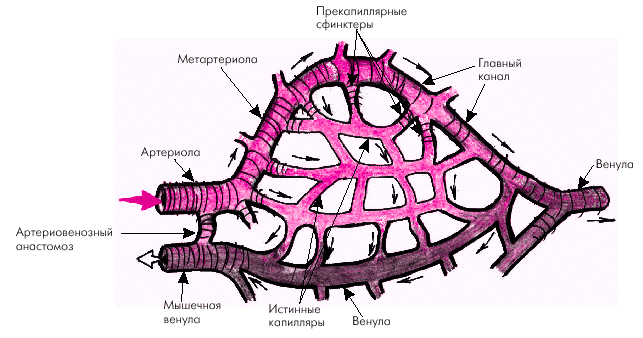
Уровень АД в концевых артериях и артериолах снижается примерно в 1,5–2 раза по сравнению с давлением в аорте, а пульсирующий кровоток постепенно сменяется непрерывным. В капиллярах, объем которых составляет около 6% объема крови, ток крови равномерный в разные фазы сердечного цикла. Истинные капилляры, т.е. сосуды, стенки которых содержат лишь один слой клеток эндотелия, лишены гладкомышечных элементов. В большинстве случаев они под прямым углом отходят от так называемых метартериол («основных каналов»), которые переходят в венулы (рис. 1.35). В области отхождения капилляров от метартериол имеются прекапиллярные сфинктеры. Именно от их сокращения или расслабления зависит, какая часть крови проходит через истинные капилляры, а какая часть по метартериолам попадает непосредственно в венулы, минуя истинные капилляры. Общий же объем кровотока через метартериолы и капилляры определяется соотношением прекапиллярного и посткапиллярного сопротивления артериол и венул.
Емкостные сосуды (венулы и вены) отличаются низким кровяным давлением. Они являются важнейшими депо крови в организме: даже в нормальных физиологических условиях в них сосредоточено до 64% крови. При патологии емкость венул и вен может увеличиваться еще больше. |
| |||||||||
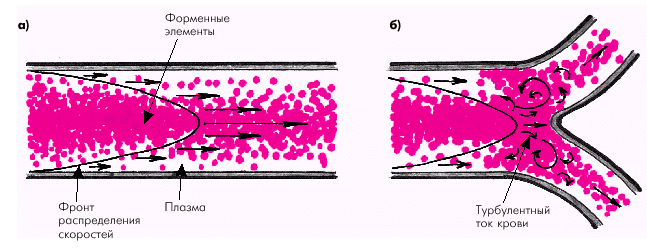
Движение крови по сосудам подчиняется законам гемодинамики. Движущей силой кровотока является градиент давления между артериальной и венозной областями сосудистой системы. У взрослого здорового человека кровоток в сосудах носит, главным образом, ламинарный характер, причем центральный осевой поток крови, состоящий в основном из форменных элементов, имеет максимальную скорость, а периферические слои, непосредственно прилежащие к стенке сосуда и состоящие из плазмы, — минимальную скорость (рис. 1.36, а). Турбулентный ток крови в норме возникает в местах разветвлений и естественных сужений и изгибов аорты и крупных артерий (рис. 1.36, б).
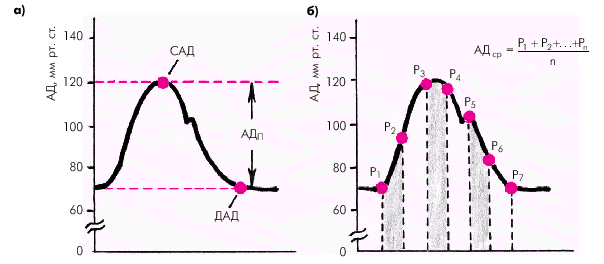
Средняя скорость кровотока в различных сосудистых областях зависит от градиента давлений в начале и в конце сосуда и величины сосудистого сопротивления, которое, в свою очередь, определяется вязкостью крови и поперечным сечением сосуда. Чем больше градиент давлений и/или чем меньше вязкость крови и суммарное поперечное сечение сосудов данной области, тем выше линейная скорость кровотока. В аорте она максимальна (50–70 см/с), в артериях и артериолах, суммарный поперечный просвет и сосудистое сопротивление которых во много раз больше, средняя линейная скорость падает (20–40 см/с в аорте и около 0,5 см/с — в артериолах). Наибольшей суммарной площадью просвета обладают капилляры. Здесь скорость движения крови не превышает 0,05 см/с. Общее время прохождения «частиц» крови по большому и малому кругам кровообращения в норме составляет примерно 23 с. Артериальное давление (АД) является важнейшим интегральным показателем функционирующей системы кровообращения. На протяжении сердечного цикла уровень АД постоянно меняется, повышаясь в начале изгнания и снижаясь во время диастолы. В момент сердечного выброса часть крови, находящейся в проксимальном сегменте восходящей аорты, получает значительное ускорение, тогда как остальная часть крови, обладающая инерцией, ускоряется не сразу. Это приводит к кратковременному повышению давления в аорте, стенки которой несколько растягиваются. По мере того как остальная часть крови ускоряет свое движение под влиянием пульсовой волны, давление в аорте начинает падать, но все же в конце систолы остается более высоким, чем в ее начале. Во время диастолы давление равномерно снижается, но АД не падает до нуля, что связано с эластическими свойствами артерий и достаточно высоким периферическим сопротивлением. Таким образом, уровень АД зависит от нескольких факторов: · величины сердечного выброса; · емкости сосудистой (артериальной) системы; · интенсивности оттока крови; · упругого напряжения стенок артериальных сосудов; · объема циркулирующей крови и т.д. Различают систолическое, диастолическое, пульсовое и среднее АД (рис. 1.37). Систолическое АД (САД) — это максимальное давление в артериальной системе, развиваемое во время систолы левого желудочка. Оно обусловлено в основном ударным объемом сердца и эластичностью аорты и крупных артерий. Диастолическое АД (ДАД) — это минимальное давление в артерии во время диастолы сердца. Оно во многом определяется величиной тонуса периферических артериальных сосудов. Пульсовое АД (АДп) — это разность между систолическим и диастолическим АД.
Среднее АД (АДср) — это результирующая всех переменных значений АД на протяжении сердечного цикла, вычисленная путем интегрирования кривой пульсового колебания давления во времени (рис. 1.37, б):
где Р1, …, Рn — переменные значения давлений на протяжении сердечного цикла, n—число измерений давления на протяжении сердечного цикла. В клинике среднее АД для периферических артерий принято вычислять по формуле:
Среднее АД является важнейшей интегральной гемодинамической характеристикой системы кровообращения. Это та средняя величина давления, которая была бы способна при отсутствии пульсовых колебаний давления дать такой же гемодинамический эффект, какой наблюдается при естественном, колеблющемся движении крови в крупных артериях (И.А. Ефимова). | |||||||||
| |||||||||
Изменения центральной и региональной гемодинамики, постоянно происходящие в организме под действием разнообразных внешних и внутренних факторов, осуществляются за счет изменений минутного объема (сердечный выброс и ЧСС) и сосудистого сопротивления (просвет кровеносных сосудов, преимущественно артериол).
Местные (периферические) механизмы
Местные механизмы саморегуляции сосудистого тонуса обеспечивают адекватный кровоток в органах в зависимости от уровня метаболизма в них. Периферические механизмы саморегуляции позволяют поддерживать необходимую объемную скорость кровотока в жизненно важных органах (головной мозг, сердце, почки) даже при резком изменении системного АД — его падении или повышении.
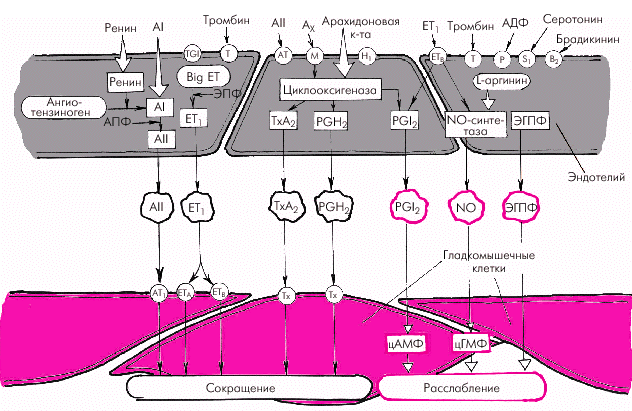
Эндотелиальные факторы Решающее значение в регуляции сосудистого тонуса придается в последние годы так называемым эндотелиальным факторам (рис. 1.38). Было установлено, что сосудистый эндотелий является местом образования целого ряда соединений, участвующих в регуляции сосудистого тонуса, функции тромбоцитов и свертывания крови. В настоящее время выделяют несколько вазодилатирующих и вазоконстрикторных субстанций.
Вазодилатирующие факторы. Основными эндотелийзависимыми вазодилатирующими факторами, оказывающими влияние на сосудистый тонус и агрегацию тромбоцитов, являются эндотелиальный расслабляющий фактор (оксид азота, NO), простациклин PGI2 и эндотелиальный гиперполяризующий фактор (ЭГПФ). 1. Эндотелиальный расслабляющий фактор (оксид азота, NO), обеспечивает выраженную релаксацию гладких мышц артерий, артериол и вен, а также препятствует адгезии и агрегации тромбоцитов. Оксид азота продуцируется сосудистым эндотелием из L-аргинина спонтанно, а также при стимулировании эндотелиальной клетки рядом биологически активных веществ и медиаторов (ацетилхолин, гистамин, брадикинин, субстанция Р и др.), продукция которых возрастает в том числе при физической нагрузке и увеличении работы сердца. Освободившийся из L-аргинина оксид азота (NO) активирует гуанилатциклазу гладкомышечной клетки с образованием цГМФ, что приводит к ее активному расслаблению (рис. 1.39).
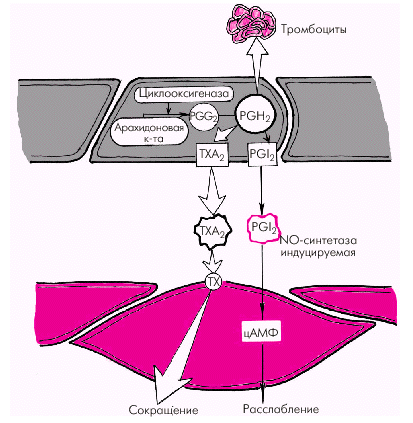
2. Простациклин также относится к числу важнейших вазодилататоров, препятствующих вазоконстрикторному эффекту тромбоксана А2 и агрегации тромбоцитов. Простациклин PGI2 является продуктом метаболизма арахидоновой кислоты, освобождающейся стимулированными тромбоцитами, из которой под действием циклооксигеназы синтезируется либо простациклин PGI2, либо тромбоксан А2 (рис. 1.40). 3. Эндотелиальный гиперполяризующий фактор (ЭГПФ), также вырабатываемый эндотелиальными клетками, вызывает гиперполяризацию мембран гладкомышечных клеток (подробнее — см. главу 3) и снижает их чувствительность к разнообразным констрикторным влияниям. Выделение ЭГПФ вызывает открытие калиевых каналов гладкомышечных клеток, что сопровождается расслаблением сосудов. Характерно, что в отличие от оксида азота, ЭГПФ выделяется эндотелием не постоянно, а только под действием некоторых стимулов (ацетилхолин, брадикинин, тромбин, гистамин, субстанция Р, АДФ, АТФ и др.).
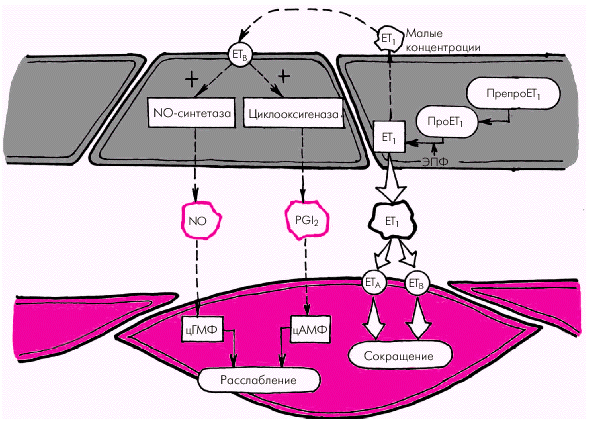
Вазоконстрикторные факторы. К числу важнейших эндотелийзависимых вазоконстрикторных субстанций, повышающих сосудистый тонус, агрегацию тромбоцитов и свертываемость крови, относятся эндотелин-1 (ЕТ1), тромбоксан А2, простагландин PGH2, ангиотензин II (АII) и др. 1. Эндотелин-1 (ЕТ1) является наиболее мощным из всех известных вазоконстрикторов. Процесс образования ЕТ1 включает несколько стадий (рис. 1.41). Вначале из предшественника эндотелинов (препроэндотелина) образуется так называемый «большой эндотелин» (проэндотелин), который, в свою очередь, под действием эндотелин-превращающего фермента (ЭПФ) трансформируется в активный полипептид, состоящий из 21 аминокислоты, — эндотелин-1 (ЕТ1). Связываясь со специфическими рецепторами клеточных мембран (ЕТА и ЕТВ), эндотелин-1 повышает внутриклеточную концентрацию ионов Са2+, что ведет к усилению сокращения гладких мышц сосудистой стенки. В физиологических условиях концентрация ЕТ1 в плазме очень мала, что связано, прежде всего, с ингибированием синтеза эндотелина-1 описанными выше вазодилатирующими субстанциями (оксидом азота и простациклином РGI2). Малые количества ЕТ1 активируют образование эндотелиальными клетками этих факторов расслабления (рис. 1.41, левая часть). В более высоких концентрациях ЕТ1 стимулирует рецепторы ЕТА и ЕТВ гладкомышечных клеток, вызывая стойкую и выраженную вазоконстрикцию (рис. 1.41, правая часть). Образование ЕТ1 усиливается при воздействии на эндотелиальные клетки тромбина, вазопрессина, интерлейкина-1, ангиотензина II и других веществ, а также при возникновении гипоксии, повышении АД, ускорении кровотока и т.п.
2. Тромбоксан А2 и простагландин РGН2 относятся к числу активных эндотелиальных вазоконстрикторов, обладающих также свойством активировать агрегацию тромбоцитов и тромбообразование. Являясь продуктами метаболизма арахидоновой кислоты, они присутствуют во многих тканях организма, в том числе в сосудистом эндотелии (см. рис. 1.38 и 1.40). Дата добавления: 2015-08-04; просмотров: 990; |
Генерация страницы за: 0.018 сек.