Химические свойства. 1. Диссоциация кислот. В водном растворе карбоновые кислоты диссоциируют:
1. Диссоциация кислот. В водном растворе карбоновые кислоты диссоциируют:
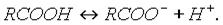
Однако это равновесие диссоциации сильно сдвинуто влево, поэтому карбоновые кислоты, как правило, слабые кислоты.
Вследствие взаимного влияния атомов в молекулах дикарбоновых кислот они являются более сильными, чем одноосновные.
2. Образование солей. Карбоновые кислоты обладают всеми свойствами обычных кислот: реагируют с активными металлами, основными оксидами, основаниями:
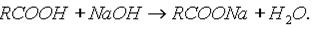
3. Образование функциональных производных. Для карбоновых кислот характерны реакции замещения гидроксильной группы в 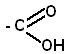 с образованием функциональных производных кислот, имеющие общую формулу R—СО—X; здесь R означает алкильную, арильную, амино- группы, группы галогенов.
с образованием функциональных производных кислот, имеющие общую формулу R—СО—X; здесь R означает алкильную, арильную, амино- группы, группы галогенов.
а) Хлорангидриды получают действием хлорида фосфора (V) на кислоты:
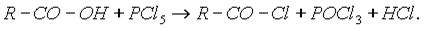
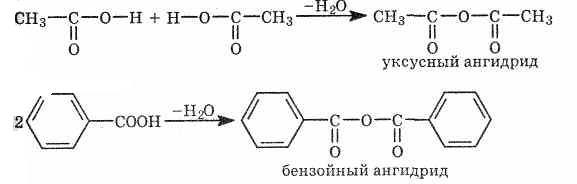
б)При нагревании кислот с водоотнимающими средствами получаются ангидриды карбоновых кислот R—СО—О—СО—R':Ангидриды — очень реакционноспособные соединения. Ангидриды - летучие жидкости, с резким запахом. Большое техническое значение имеет уксусный ангидрид, кроме того он применяется для синтеза фармацевтических препаратов, красителей.
в) Сложные эфиры образуются при нагревании кислоты со спиртом в присутствии серной кислоты - реакция этерификации:
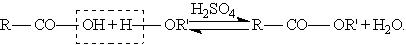
г) Реакции хлорангидридов карбоновых кислот с аммиаком приводят к образованию амидов:
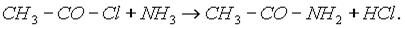
Амидами карбоновых кислот называются производные этих кислот, в которых гидроксилъная группа замещена на аминогруппу. Общая формула амидов RCONH2. Функциональная группа СONH2 называется амидогруппой.
К амидам кислот относится мочевина. Это конечный продукт азотистого обмена в организме человека и животных. Образуется при распаде белков и выделяется вместе с мочой. Мочевину можно рассматривать как полный амид угольной кислоты:

4. Окислительно-восстановительные реакции карбоновых кислот.
Карбоновые кислоты при действии восстановителей способны превращаться в альдегиды или спирты:
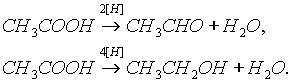
Насыщенные карбоновые кислоты устойчивы к действию концентрированных серной и азотной кислот. Исключение составляет муравьиная кислота:
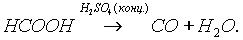
Муравьиная кислота НСООН отличается рядом особенностей, поскольку в ее составе есть альдегидная группа:
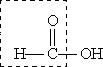
Муравьиная кислота — сильный восстановитель и легко окисляется до СО2. Она дает реакцию “серебряного зеркала”:

Кроме того, муравьиная кислота окисляется хлором:
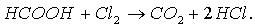
Нитрил муравьиной кислоты –циноводород H–CN, или синильная кислота.
7. Для дикарбоновых кислот присущи реакции образования циклических ангидридов:
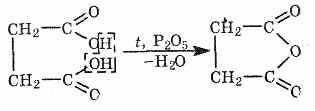
янтарная кислота ангидрид янтарной кислоты
Дата добавления: 2015-08-04; просмотров: 1349;
