Химические свойства спиртов
Диссоциация спиртов на ионы происходит в незначительной степени, поэтому спирты дают нейтральную реакцию — в их присутствии не изменяется окраска лакмуса или фенолфталеина.
Кислотные свойства спиртов выражены очень слабо. Низшие спирты бурно реагируют с щелочными металлами с образованием алкоголятов (в данном примере – этилалкоголята калия):
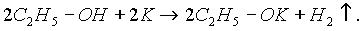
Спирты вступают в реакции замещения с галогеноводородами:
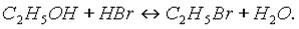
С кислотами (органическими или неорганическими) спирты вступают в реакцию этерификации в присутствии серной кислоты с образованием сложных эфиров:
O O
// H+ //
H3C—С—OH + HO—C2H5 → H3C—C—O—C2H5 + H2O
уксусная этиловый эфир
кислота уксусной кислоты
(этилацетат)
При нагревании спирта в присутствии сильной кислоты происходит отщепление молекулы воды от двух молекул спирта в результате межмолекулярной дегидратации и образуется простой эфир (в данном примере – диэтиловый эфир):
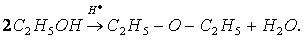
Диэтиловый или серный эфир — хороший растворитель многих органических веществ, применяется для чистки тканей, а в медицине — при хирургических операциях, так как обладает анестезирующим действием.
Спирты вступают в реакции отщепления воды - элиминирования, или внутримолекулярной дегидратации, с образованием непредельных углеводородов. Данная реакция становится преобладающей при использовании больших количеств кислоты:
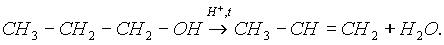
Спирты ступают в реакции окисления. Окисление – это процесс увеличения числа атомов кислорода в молекулах органических соединений и уменьшения числа атомов водорода. Первичные спирты окисляются в альдегиды, которые, в свою очередь, могут окисляться в карбоновые кислоты:

Вторичные спирты окисляются в кетоны:
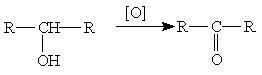
Третичные спирты более устойчивы к окислению. При действии на них сильных окислителей может происходить расщепление углеродного скелета молекулы третичного спирта с образованием карбоновых кислот и кетонов с меньшим числом углеродных атомов, чем в молекуле исходного третичного спирта. Окисление обычно проводят дихроматом или перманганатом калия с серной кислотой.
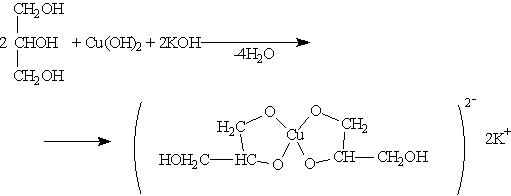
При взаимодействии гидроксида меди (II) с глицерином и другими многоатомными спиртами происходит растворение гидроксида и образуется комплексное соединение синего цвета. Эта реакция используется для обнаружения многоатомных спиртов:
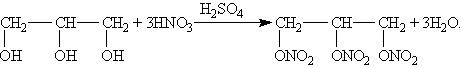
Для многоатомных спиртов характерно образование сложных эфиров. В частности, при реакции глицерина с азотной кислотой в присутствии каталитических количеств серной кислоты образуется тринитрат глицерина (нитроглицерин):
Применение спиртов:Этиленгликоль применяют:
1) в качестве антифриза; 2) для синтеза высокомолекулярных соединений (например, лавсана).
Глицерин применяют:
1) в парфюмерии и в медицине (для изготовления мазей, смягчающих кожу); 2) в кожевенном производстве и в текстильной промышленности;
3) для производства нитроглицерина.
Дата добавления: 2015-08-04; просмотров: 867;
