Основные компоненты физико-химического состава природных вод
Химические компоненты природных вод делят на 6 групп:
- главные ионы;
- растворенные газы;
- растворенные органические вещества;
- микроэлементы;
- биогенные вещества;
- токсичные элементы.
Иногда выделяют еще одну группу – взвешенные вещества.
Главные ионы. В значительных количествах в природных водах присутствуют ионы: Na+, K+, Ca2+, Mg2+, HCO3– (CO32– ) , SO42–, Cl–, которые и называют главными ионами. Содержание их в пресных водоемах изменяется в широких пределах.
Экспериментально установлено, что в открытом океане независимо от абсолютной концентрации соотношения между главными ионами основного солевого состава остаются примерно постоянными.
Предложено подразделять все природные воды по преобладающему аниону на три класса:
- гидрокарбонатные (карбонатные);
- сульфатные;
- хлоридные.
Каждый класс по преобладающему катиону подразделяется на три группы:
- кальциевую;
- магниевую;
- натриевую.
Гидрокарбонатный и карбонатный ионы являются важнейшей составной частью ионного состава пресных и маломинерализованных природных вод суши. Появляются эти ионы в воде в результате растворения солей угольной кислоты – карбонатов кальция и магния.
Соли СаСО3 и MgCO3 трудно растворимы в воде и могут перейти в раствор только в присутствии углекислого газа
СаСО3 + СО2 + Н2О = Са(НСО3)2
Ионы НСО3–, СО32–, Са2+, Н+ и Н2СО3 находятся между собой в растворе в определенных количественных отношениях, определяющихся константой диссоциации угольной кислоты по первой и второй ступени (К1 = 3 . 10– 7 , К2 = 4 . 10– 11). Эти ионы и угольная кислота образуют карбонатную систему химического равновесия, т.е. изменение содержания одного из них влечет за собой изменение содержания другого, что имеет большое значение для поддержания реакции среды в природных водах.
Хлорид – ионы обычно занимают первое место среди анионов в воде океанов, морей, сильно минерализованных озер, меньше их в воде рек. Источники хлорид-ионов в воде – продукты выветривания магматических пород, в которых хлор присутствует в рассеянном состоянии, колоссальные залежи хлористых солей осадочных пород, вулканические выбросы. Широкому распространению хлоридов в природных водах суши в значительной мере способствует деятельность человека, т.к. большое промышленное и физиолобиологическое значение NaCl способствует рассеянию его по земной поверхности. Ионы Cl– не усваиваются растениями и бактериями и выделяются в свободном состоянии организмами животных, поэтому круговорот их в земной коре несложен. Повышенное содержание хлоридов ухудшает вкусовые качества воды, делает ее малопригодной для питьевого водоснабжения и ограничивает применение для других целей. Концентрация хлоридов и ее колебания могут служить одним из критериев загрязненности водоема хозяйственно-бытовыми стоками.
Сульфат – ионы также важнейшие анионы природной воды и вместе с хлорид-ионами составляют главную часть анионного состава воды морей и сильно минерализованных озер. Содержание сульфат-ионов в природных водах лимитируется присутствием в воде катионов Са2+, которые образуют с сульфат-ионами малорастворимое соединение CaSO4.
Основными источниками растворенных в воде сульфатов являются различные осадочные породы, в состав которых входит гипс СаSO4 . 2H2O. Источниками сульфат-ионов в природной воде служат и процессы окисления самородной серы, протекающие по уравнению
2S + 3 O2 + 2 H2O = 2 H2SO4,
а также окисление широко распространенных в земной коре сульфидных соединений.
На содержание сульфат-ионов в природных водах оказывают влияние процессы распада и окисления органических веществ растительного и животного происхождения, содержащих серу. Вблизи населенных пунктов присутствие сульфат-ионов в воде часто оказывается результатом загрязнения ее бытовыми и промышленными сточными водами.
Сульфат-ионы являются устойчивыми. При отсутствии кислорода сульфаты могут быть восстановлены обычно под действием сульфатредуцирующих бактерий, обнаруженных в морях и в водах нефтеносных месторождений, до сероводорода. Получающийся в процессе восстановления сульфатов сероводород в дальнейшем при соприкосновении с воздухом вновь окисляется вначале до серы
2 H2S + O2 = 2 H2O + 2 S,
а затем до сульфатов.
Повышенное содержание сульфатов в воде ухудшает ее органолептические свойства. Сульфаты могут придавать воде слабительные свойства, поэтому их содержание строго регламентируется.
При значительном содержании в воде хлоридов и сульфатов они являются причиной ее агрессивности по отношению к бетону. Так, сульфат-ионы могут взаимодействовать с известью цемента с образованием гипса, что вызывает увеличение объема и образование трещин в бетоне. Присутствие в воде значительного количества хлоридов приводит к выщелачиванию и разрушению бетонного камня вследствие образования растворимых хлоридов кальция и магния.
Ионы щелочных металлов. Из ионов щелочных металлов в природных водах в наибольших количествах находятся ионы Na+, в значительно меньших – ионы К+. Подобно хлорид–ионам, ионы Na+ являются характерными ионами сильноминерализованных вод.
Важнейшим источником катионов натрия в природных водах являются его залежи в виде хлористых солей, находящиеся среди различных осадочных пород морского, а в засушливых районах и континентального происхождения.
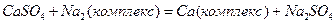 |
Другим источником ионов щелочных металлов в природной воде являются продукты выветривания горных пород. Калий содержится, главным образом, в кислых изверженных породах (ортоклаз, мусковит), а натрий входит в состав различных алюмосиликатов. Кроме того, в ряде случаев происходит обменная адсорбция ионов Са2+ и Na+ в породах, в результате чего в растворе взамен ионов Са2+ появляется эквивалентное количество ионов Na+ по схеме:
Ионы магния и кальция. Если в сильноминерализованных водах доминирует катион натрия, то в маломинерализованных водах обычно доминирует катион кальция, гораздо реже – магния.
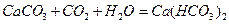 |
Основным источником катионов Са2+ в природных водах являются известняки, которые растворяются угольной кислотой, находящейся в воде, с образованием гидрокарбонатов
Другим источником катионов Са2+ в природных водах является гипс, весьма распространенный в осадочных породах.
Катионы магния поступают в воду преимущественно при растворении доломитов (MgCO3.CaCO3), мергелей или продуктов выветривания коренных пород.
Присутствие катионов кальция и магния обусловливает жесткость воды.
Растворенные газы. Из растворенных в воде газов наибольшее значение имеют кислород и оксид углерода (IV) (углекислый газ), а также азот, сероводород, метан и др.
Растворимость газа в воде зависит от его природы, парциального давления и температуры. Для данной температуры растворимость может быть определена по закону Генри:
С = К×Р,
где С – растворимость газа, мг/дм3;
К – коэффициент пропорциональности, равный растворимости
газа при данной температуре и давлении 1 атм;
Р – парциальное давление газа, атм.
Концентрация любого газа в воде стремится перейти в равновесие с парциальным давлением этого газа над водой, поэтому непрерывно происходят обратимые процессы сорбции и десорбции.
Кислород находится в природной воде в виде растворенных молекул. Его присутствие является обязательным условием для существования большинства организмов, населяющих водоемы.
Вода обогащается кислородом за счет растворения кислорода атмосферы и за счет его выделения водной растительностью в процессе фотосинтеза. Дождевые и снеговые воды обычно пересыщены кислородом, поэтому их поступление в водоем увеличивает его аэрацию. Уменьшение содержания растворенного кислорода в воде происходит вследствие его выделения в атмосферу и из-за потребления на окисление органических веществ при дыхании организмов, брожении, минерализации органических остатков. Наличие растворенного кислорода является одной из причин коррозионной агрессивности воды по отношению к металлам. Концентрация кислорода определяет величину окислительно-восстановительного потенциала и в значительной мере направление и скорость процессов химического и биохимического окисления. Кислородный режим оказывает сильное влияние на жизнь водоема.
Содержание кислорода в воде обычно выражают в мг/дм3, в природных водах его содержание колеблется в пределах от 0 до 14 мг/дм3.
Углекислый газ. Углекислый газ находится в воде главным образом в виде растворенных молекул СО2. Однако часть их, около 1%, вступает во взаимодействие с водой, образуя угольную кислоту
СО2 + Н2О = Н2СО3
Обычно же не разделяют СО2 и Н2СО3 и под углекислым газом подразумевают их сумму.
Источником углекислого газа в природных водах являются, прежде всего, процессы окисления органического вещества, происходящие как непосредственно в воде, так и в почвах и илах, с которыми соприкасается вода. Сюда относятся дыхание водных организмов и различные виды брожения распадающихся органических остатков. Обогащают воду углекислым газом и геохимические процессы в осадочных породах. Поглощение СО2 из атмосферы наблюдается почти исключительно в морях и очень редко в водах суши.
Из процессов, направленных на уменьшение СО2 в природных водах, важнейшими являются удаление в атмосферу из-за перенасыщенности воды этим газом; расходование его на переход карбонатных пород в раствор; потребление водной растительностью при фотосинтезе.
Содержание углекислого газа в природных водах колеблется в очень широких пределах: от нескольких десятков долей до нескольких сотен мг/дм3. Наименьшее его количество наблюдается в морях, наибольшее – в подземных водах. Обычно весной и летом содержание диоксида углерода в водоеме понижается, а в осенне-зимний период увеличивается, достигая максимума в конце зимы. Повышенные концентрации СО2 угнетающе действуют на животные организмы. В реках и озерах из-за постоянного выделения в атмосферу, а также значительного потребления при фотосинтезе содержание СО2 редко превышает 20-30 мг/дм3. При высоких концентрациях углекислого газа воды становятся агрессивными по отношению к металлам и бетону, т.к. при этом образуются растворимые гидрокарбонаты, нарушающие структуру этих материалов.
Прочие газы. Появление в природных водах сероводорода и метана указывает на наличие гнилостных процессов, протекающих в водоемах при ограниченном доступе воздуха. В природных условиях как сероводород, так и метан чаще встречаются в подземных водах. Однако наличие этих газов, в особенности Н2S, в реках и озерах может быть следствием сброса неочищенных сточных вод.
Растворенные органические вещества. Эта группа веществ включает различные органические соединения: органические кислоты, спирты, альдегиды и кетоны, сложные эфиры, белки, углеводы, амины, свободные аминокислоты и т.д. По происхождению растворенные органические вещества можно разделить на автохтонные – продукты метаболизма и биохимического распада остатков организмов – и аллохтонные, которые поступают в водную среду с поверхностными стоками с площади водосбора с ливневыми и талыми водами, с атмосферными осадками и сточными водами.
При разложении отмерших растений и их гумификации образуется сложная смесь высокомолекулярных органических соединений – гумусовые вещества, прежде всего гуминовые кислоты и фульвокислоты. Поверхностный сток с заболоченной площади водосбора приносит в природную воду большое количество этих веществ. Окраска природных вод связана, как правило, с наличием в водоеме гумусовых веществ. Содержание гумусовых веществ в речных водах около 5 – 10 мг/дм3, в озерных до 150 мг/дм3.
Загрязнение природных вод происходит и ядохимикатами, применяемыми в сельском хозяйстве.
К числу постоянных источников органического вещества следует отнести также бытовые и промышленные сточные воды, попадающие в подземные воды и реки. Состав этих веществ весьма различен. К ним относятся поверхностно-активные вещества (ПАВ), фенолы, нефтепродукты и др.
Ввиду сложности определения индивидуальных органических веществ, их многообразия и малых природных концентраций для их количественной характеристики используют косвенные показатели: общее содержание Сорг; Nорг; Рорг, перманганатную или дихроматную окисляемость воды (ХПК), биохимическое потребление кислорода (БПК).
Микроэлементы. В природных водах установлено наличие более 70 химических элементов. Веществ, совершенно не растворимых в воде, нет и каждый элемент, встречающийся в земной коре, содержится и в природных водах. К микроэлементам, по А.П. Виноградову, относятся те элементы, содержание которых в воде меньше 10–3 %. В группу микроэлементов входят все металлы, кроме главных ионов и железа, а также некоторые анионы.
Тяжелые металлы (медь, кобальт, никель, марганец, цинк и др.) находятся в природных водах в небольших количествах, что объясняется небольшим содержанием их в почвах и грунтах.
Среднее содержание ионов брома в пресных водах колеблется в пределах 0,001 – 0,2 мг/дм3. Содержание ионов иода значительно меньше – до 0,003 мг/дм3, в морских водах оно повышается до 0,05 мг/дм3. Содержание фтора в воде озер, рек и артезианских скважин колеблется в пределах 0,04 – 0,3 мг/дм3. Содержание бора в пресных водах примерно 0,01 мг/дм3, в морских водах – 1,5 – 4,4 мг/дм3.
Биогенные вещества.К биогенным принадлежат вещества, в той или иной мере связанные своим происхождением с жизнедеятельностью водных организмов. Присутствие этих веществ в воде, в свою очередь, определяет возможность существования водных организмов. Выделение этой группы является несколько условным, т.к. в жизненных процессах принимают участие и другие ионы, в частности ионы Са2+, Mg2+, К+. Биогенные вещества находятся в воде в виде ионов, а также в виде коллоидов.
Соединения азота.Из неорганических соединений азота в природной воде встречаются катионы аммония (NH4+), нитритные (NO2–) и нитратные (NO3–) анионы. Сходство их генезиса и возможность взаимного перехода одного в другой дают основание объединить их в одну группу.
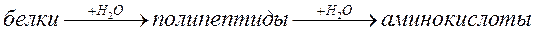 |
Основным источником появления в природной воде NH4+, а затем NO3– и NO2– являются различные сложные органические вещества животного и растительного происхождения, содержащие в своем составе белок. Некоторые микроорганизмы способны под действием протеолитических ферментов расщеплять молекулы белка на пептидные цепочки и отдельные аминокислоты:
Образовавшиеся аминокислоты далее разлагаются при участии бактерий и ферментов с выделением аммиака.
Разложение (дезаминирование) аминокислот может осуществляться при участии воды (гидролитическое дезаминирование)
R CHNH2COOH + H2O ® R CHOH – COOH + NH3;
кислорода (окислительное дезаминирование)
R CHNH2COOH + O2 ® R–СО–COOH + NH3
и водорода (восстановительное дезаминирование)
R CHNH2COOH + H2 ® R CH2COOH + NH3.
Процесс разложения продуктов гидролиза белковых соединений микроорганизмами с выделением аммиака называется аммонификацией.
Вместе с тем катионы аммония могут появляться и другим путем – из неорганических соединений. Замечено присутствие NH4+ в болотистых водах, богатых гумусовыми веществами, которые, по-видимому, способны восстанавливать нитраты до NH4+. Нитраты и нитриты могут быть восстановлены до NH4+ и другими веществами, например, сероводородом и железом (II). Кроме того, NH4+ часто попадает в водоемы в составе промышленных сточных вод, например, азотно-туковых, содовых, коксо-газовых и других заводов.
Наличие аммиака в воде всегда вызывает подозрение в загрязнении воды сточными водами.
В природной воде аммиак довольно неустойчив и под влиянием нитрифицирующих бактерий окисляется сначала до азотистой кислоты, а затем до азотной кислоты (реакции нитрификации)
2 NH3 + О2 = 2 НNО2 + 2 Н2О
(NH4)2СО3 + 3 О2 = 2 НNО2 + СО2 + 3 Н2О
2 НNО2 + О2 = 2 НNО3
Другим важнейшим источником непосредственного обогащения природных вод нитратами являются получающиеся при атмосферных электрических разрядах оксиды азота, которые после поглощения атмосферными водами попадают на земную поверхность. Нитратные ионы встречаются в поверхностных природных водах в количествах несколько больших, чем нитритные. В то же время в подземных водах содержание нитритов обычно значительно выше, особенно в верхних водоносных горизонтах.
При исследовании поверхностных вод по соотношению содержания в них аммиака, нитритов и нитратов можно судить о времени загрязнения воды. Так, наличие в воде аммиака и отсутствие нитритов указывает на свежее загрязнение воды. Отсутствие аммиака в воде при наличии нитритов и особенно нитратов свидетельствует, что загрязнение воды произошло давно, и прошел процесс самоочищения.
Соединения фосфора. Минеральный фосфор в природных водах в растворенном состоянии находится главным образом в виде гидрофосфат-иона НРО42–, в меньшей мере дигидрофосфат- иона Н2РО4–, еще меньше фосфат – иона РО43–. Содержание тех или иных ионов ортофосфорной кислоты определяется реакцией среды.
Органический растворенный фосфор является составной частью сложных органических соединений. Фосфор может находиться в природной воде и во взвешенных частицах как минерального, так и органического происхождения.
Соединения фосфора, хотя и присутствуют в природных водах в ничтожных количествах, имеют исключительно важное значение для развития растительной жизни, являясь зачастую одним из факторов, лимитирующих и определяющих развитие растительных организмов и, следовательно, продуктивность водоемов. Именно увеличение содержания фосфора в пресных водоемах обычно становится причиной их эвтрофирования.
Соединения железа очень часто встречаются в природных водах вследствие перехода их в раствор из различных горных пород, в которых железо широко распространено. Переход железа в раствор может происходить под действием окислителей или кислот. В болотистых водах железо часто находится в виде сложных гумусовых комплексов.
Форма, в которой железо находится в природных водах, может быть весьма разнообразной. Преобладающее в подземных водах закисное железо присутствует в воде водоемов в виде растворимых солей гидрокарбоната железа (II) Fe(HCO3)2 и карбоната FeCO3, которые устойчивы только при содержании больших количеств СО2 и отсутствии кислорода. В противном случае происходит гидролиз, и железо переходит в малорастворимый гидроксид железа (II)
Fe(HCO3)2 + 2 Н2О = Fe(OН)2 + 2 Н2СО3,
который далее легко окисляется в гидроксид железа (III)
4 Fe(ОH)2 + О2 + 2 Н2О = 4 Fe(ОH)3.
Процесс окисления во многих случаях протекает при участии микроорганизмов, которые используют выделяющуюся при этом энергию в процессе жизнедеятельности.
Fe(ОH)3 очень мало растворим, но может присутствовать в растворе в коллоидном состоянии, которое, по-видимому, является основной формой существования железа в поверхностных водах.
Воды, содержащие железо в значительных количествах, обычно имеют кислую реакцию среды. Это характерно для железистых вод, если происхождение железа связано с растворением сульфата железа (III).
Fe2(SO4)3 + 6 H2O = 2 Fe(OH)3 + 3 H2SO4
Соединения железа (III) чаще встречаются в поверхностных водах (сотые, реже десятые доли мг/дм3), соединения железа (II) –преимущественно в подземных водах в несколько больших количествах (до 1 мг/дм3).
Соединения кремния. Повсеместное распространение кремния в природе обеспечивает его непрерывное поступление в природные воды в виде выщелачиваемой водой кремневой кислоты и ее щелочных солей, содержащих ионы HSiO3– и SiO32–, а часть кремния находится в коллоидном состоянии, в частицах состава SiO2´ Н2О, а также в виде поликремневой кислоты состава х SiO2 ´уН2О. Кроме того, в водах присутствуют и органические соединения кремния.
Наибольшие количества кремния встречаются в подземных водах, наименьшие – в поверхностных слоях открытых водоемов, где растения потребляют кремний. Обычно содержание кремния в открытых водоемах колеблется от десятых долей мг/дм3 в морях до 10 мг/дм3 в водах суши.
Токсичные вещества.К этой группе веществ относят тяжелые металлы (ртуть, кадмий, свинец и др.), нефтепродукты, хлорорганические и другие пестициды, фенолы, синтетические поверхностно-активные вещества (СПАВ) и т.д.
Взвешенные вещества. Содержание взвешенных веществ в воде называется мутностью и выражается в г/м3 или мг/дм3. Мутность речной воды зависит от скорости течения и расхода воды. Основная причина наличия взвешенных частиц – эрозия русла и склонов. В некоторых водоемах источником взвешенных веществ органического происхождения является планктон, развитие которого наблюдается преимущественно в летние месяцы.
Производственные сточные воды нередко содержат значительные количества взвешенных частиц. Допустимое увеличение концентрации их в природных водах жестко нормируется.
Дата добавления: 2015-08-04; просмотров: 2231;
