Жидкостно-мозаичная модель биологических мембран
В 1972 г. Джонатан Сингер и Гарт Николсон предложили жидкостно-мозаичную модель, объясняющую в общих чертах организацию биологических мембран. Согласно этой модели, мембраны представляют собой двумерные растворы определенным образом ориентированных фосфолипидов и глобулярных белков которые пронизывают мембрану насквозь (интегральные белки) или погружены в ее толщу (периферические белки).
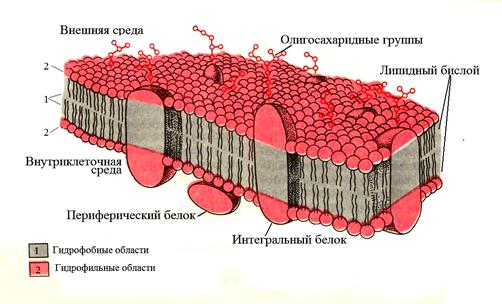
Рис. 2. Жидкостно-мозаичная модель строения плазматической мембраны.
Большая часть мембранных фосфолипидов и гликолипидов представлена в виде бислоя который играет двоякую роль. Во-первых, небольшая часть мембранных липидов специфически связана с определенными мембранными белками и, вероятно, необходима для их функционирования. Во-вторых, будучи гидрофобными, мембранные фосфолипиды являются барьером проницаемости, обеспечивая одну из базовых функций клетки – барьерную (защитную), благодаря которой внутреннее содержимое клетки надежно отделено от внешней среды.
Молекулы белков встроены (интеркалированы) в фосфолипидный матрикс клеточной мембраны. Все мембранные белки свободно перемещаются в липидном матриксе в латеральном направлении, но не могут перемещаться в поперечном направлении, т.е. от одной поверхности мембраны к другой.
Благодаря высокой химической активности, специфическими белками выполняются многие важные функции мембран связанные с распознаванием сигналов, ферментативной активностью, преобразованием энергии, переносом веществ. Белки, прикрепленные к поверхности клеточной мембраны (в основном к внутренней ее части), называют периферическими, они, как правило, являются ферментами (ацетилхолинестераза, фосфатазы, аденилатциклаза, протеинкиназы). Некоторые интегральные белки также выполняют функцию ферментов, например АТФаза. Рецепторами и антигенами мембраны могут быть как интегральные, так и периферические белки. Белки, примыкающие к мембране с внутренней стороны, являются также составной частью цитоскелета, который обеспечивает дополнительную прочность клеточной мембране и ее эластичность.
Важнейшей функцией интегральных белков является перенос веществ через клеточную мембрану. (транспортная функция) – процесс, имеющий фундаментальное значение для всех живых клеток, так как обеспечивает обмен веществ и поддержание гомеостаза. Кроме того, за счет переноса заряженных частиц – ионов - работой транспортных систем поддерживается электрическая активность плазматической мембраны, лежащая в основе раздражимости и возбудимости.
Основную роль в возникновении и поддержании электрических состояний мембраны играют следующие ее транспортные системы: первично активного транспорта – ионные насосы (помпы), - работа которых обеспечивает формирование и восстановление заряда мембраны, и вторично активного транспорта – ионные каналы, - которые играют основную роль в изменении заряда мембраны при действии раздражителя.
Насосы представляют собой белковые молекулы, обладающие свойствами переносчика и АТФ-азной активностью. Обычно указывают на существование трех ионных насосов: натрий-калиевого, кальциевого и водородного, есть основание предполагать наличие и хлорного насоса. Насосы локализуются на клеточных мембранах или мембранах органелл клеток.
В результате работы ионных насосов плазматической мембраны создаются и поддерживаются трансмембранные ионные градиенты, определяющие заряд мембраны – мембранный потенциал:
· концентрация Na+, Ca2+, Cl– внутри клетки ниже, чем снаружи (в межклеточной жидкости)
· концентрация K+ внутри клетки выше, чем снаружи.
Натрий-калиевый насос (Na/K-АТФаза) — это интегральный белок клеточной мембраны, обладающий, как и все другие насосы, свойствами фермента, т. е. сам переносчик обеспечивает расщепление АТФ и освобождение энергии, которую он же сам и использует. Более трети энергии АТФ, потребляемой клеткой в состоянии покоя, расходуется на перенос только ионов Na+ и К+. Этот насос имеется в мембранах всех клеток и создает характерный признак живого — градиент концентрации Na+ и К+ внутри и вне клетки, что обеспечивает формирование мембранного потенциала и вторичный транспорт веществ. Главными активаторами насоса являются гормоны (альдостерон, тироксин), ингибирует насос недостаток энергии (кислородное голодание), его специфическими блокаторами являются строфантины, особенно уабаин. Работа натриевого насоса после удаления К+ из среды сильно нарушается.
Кальциевый насос локализуется в эндоплазматическом ретикулуме и в клеточной мембране, он обеспечивает транспорт Са2+. Насос строго контролирует содержание Са2+ в клетке, поскольку изменение содержания Са2+ в ней нарушает ее функционирование. Насос переносит Са2+ либо во внеклеточную среду (в гладких мышцах), либо в цистерны ретикулума (в поперечно-полосатых мышцах) и митохондрии (внутриклеточное депо Са2+).
Протонный насос работает в митохондриях .
Хлорный насос работает, по-видимому, подобно всем другим помпам и играет главную роль в процессах торможения ЦНС.
Механизм работы ионных насосов заключается в следующем. Na+/K+-насос переносит за один цикл 3Na+ из клетки и 2К+ в клетку . Это осуществляется в результате конформации (изменения третичной структуры) молекулы белка в форму при которой его активный участок способен связывать либо Na+ (форма Е1), либо К+ (форма Е2). При конформации Е1 активная часть белка обращена внутрь клетки где и связывает Na+, вследствие чего активируется его АТФ-аза, в результате белок превращается в форму Е2 и активный участок поворачивается наружу клеточной мембраны. Теперь он теряет сродство к Na+, который отщепляется, а приобретает сродство к иону К+ и соединяется с ним. Это снова ведет к изменению конформации переносчика: форма Е2 переходит в форму Е1 , а активный участок белка опять поворачивается внутрь клетки. При этом он теряет сродство к иону К+, который отщепляется, а белок приобретает снова сродство к иону Na+, т.е. цикл повторяется.
Насос является электрогенным, поскольку за один цикл выводится из клетки три иона Na+, а возвращаются в клетку два иона К+. Энергия расходуется только на перенос Na+. На Обеспечение одного цикла работы Na/K-помпы расходуется одна молекула АТФ.
Подобным образом работают и Са-АТФазыэндоплазматического ретикулума, а также клеточной мембраны, с тем лишь различием, что переносятся только ионы Са2+ и в одном направлении: из гиалоплазмы в эндоплазматический ретикулум либо наружу клетки.
Ионные каналы – интегральные белки, которые обеспечивают пассивный транспорт ионов по градиенту концентрации. Энергией для транспорта служит разность концентрация ионов по обе стороны мембраны (трансмембранный ионный градиент), который создается работой мембранных насосов.
Наличие ионных каналов впервые было доказано для мембран нервной ткани. Структурно каналы представляет собой, как бы, «поры» которые имеют устье и селективный фильтр, а управляемые каналы — и воротный механизм. Каналы способны пропускать ионы через мембрану с огромной скоростью, через один ионный канал может проходить 107- 108 ионов в секунду. Количество каналов на единицу площади мембраны так же очень велико, поэтому суммарный заряд переносимых ионов может быть относительно большим. Движение зараженных ионов, создает ток, текущий через плазматическую мембрану клетки. Изменение величины и направления этого тока, приводит к изменению заряда самой плазматической мембраны и воспринимается клеткой как изменение окружающей среды. Этот процесс и лежит в основе электрической природы раздражимости.
Классификация ионных каналов проводится по нескольким признакам.
· По возможности управления их функциейразличают управляемые и неуправляемые каналы (каналы
утечки ионов). Через неуправляемые каналы ионы перемещаются постоянно, но медленно. Управляемые каналы имеют управляемый воротный механизм, поэтому ионы через них могут проходить только при открытых воротах.
· По скорости движения ионов каналы могут быть быстрыми и медленными.
· Различают несколько видов управляемых ионные каналов в зависимости от активирующего или
инактивирующего их стимула. В обеспечении электрической активности клетки основную роль играют потенциал- и хемочувствительные каналы.
а) потенциалчувствительные (электроуправляемые) – их воротный механизм чувствителен к заряду мембраны (мембранному потенциалу). Состояние воротного механизма, состоящего из активационных и инактивационных ворот, определяет три состояния такого канала: «закрытый», «открытый» и «инактивированный».
В покое активационные ворота закрыты, инактивационные ворота открыты, канал находится в состоянии «закрытый». При снижении мембранного потенциала (деполяризации) на определенную (пороговую) величину активационные ворота открываются, и начинается транспорт ионов через канал (канал «открыт»). Это приводит к дальнейшей деполяризации мембраны, и как следствие к закрытию инактивационных ворот и прекращению транспорта ионов (канал «инактивирован»). «Инактивированный» канал, в отличие от «закрытого», не может быть открыт ни при каких условиях. Восстановление исходной величины мембранного потенциала (реполяризация) переводит канал в исходное состояние - «закрытый», и цикл его активности может быть повторен.
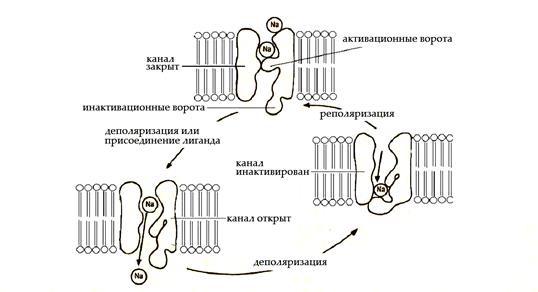
Рис.3. Состояния селективного ионного канала и условия перехода между ними.
б) хемо-чувствительные (хемо-управляемые) – воротный механизм этих каналов структурно связан с белком-рецептором чувствительным к определенным химическим веществам. При взаимодействии медиатора (лиганда) с рецепторами, расположенными на поверхности клеточной мембраны, в результате конформационных изменений, происходит открытие ворот этих каналов, поэтому их называют также рецепторуправляемыми каналами. Разрушение связи между рецептором и медиатором приводит к закрытию канала.
Следует отметить, что по современным представлениям, большинство каналов имеет смешанное регулирование: от заряда мембраны зависит вероятность открытия канала, а от химического регулятора - время нахождения в открытом состоянии.
Можно выделить также:
в) механочувствительные – эти каналы активируются и инактивируются сдавливанием и растяжением.
г) кальций-чувствительные – это один из примеров хемо-чувствительных каналов которые активируются кальцием, причем Са2+ может активировать как собственные каналы, например Са-каналы саркоплазматического ретикулума, так и каналы других ионов, например каналы ионов К+.
д) каналы, чувствительные ко вторым посредникам – расположены во внутриклеточных мембранах, они изучены недостаточно, так же как и кальций-чувствительные каналы.
Плазматическая мембраны возбудимых клеток может содержать потенциало-, хемо-, механо- и кальцийчувствительные каналы.
Каналы одного и того же вида могут влиять на активность друг на друга. Так, открытие одних электроуправляемых каналов способствует активации рядом расположенных электрочувствительных каналов, в то время как открытие одного хемо- или механочувствительного канала практически не влияют на состояние соседних таких же каналов. Частичная деполяризация клеточной мембраны за счет активации хемо- или механочувствительных каналов может привести к активации потенциалчувствительных каналов.
· В зависимости от селективностиразличают ионоселективные каналы, пропускающие только один
ион, и каналы, не обладающие селективностью. Имеются Na-, K-, Са-,С1- и Na/Ca-селективные каналы. Наиболее высока степень селективности потенциалчувствительных (потенциалзависимых) каналов, несколько ниже она у хемочувствительных (рецепторзависимых) каналов. Механочувствительные каналы являются вообще неселективными.
Один и тот же ион может транспортироваться несколькими видами каналов. Наиболее важными из них для формирования биопотенциалов являются следующие.
Каналы для К+:
а) неуправляемые каналы покоя (каналы утечки) через которые К+ постоянно выходит из клетки, что является главным фактором в формировании мембранного потенциала (потенциала покоя);
б) потенциалчувствительные, управляемые К-каналы;
в) К-каналы, активируемые Са2+;
г) каналы, активируемые и другими ионами и веществами, например ацетилхолином, что обеспечивает, например, гиперполяризацию миоцитов сердца.
Каналы для Na+ :
а) потенциалчувствительные быстрые Na-каналы — быстро активирующиеся при уменьшении мембранного потенциала, обеспечивают вход Na+ в клетку во время ее возбуждения;
б) рецепторуправляемые Na-каналы, активируемые ацетилхолином в нервно-мышечном синапсе, глутаматом — в синапсах нейронов ЦНС;
в) медленные неуправляемые Na-каналы — каналы утечки, через которые Na+ постоянно диффундирует в клетку и переносит с собой другие молекулы, например глюкозу, аминокислоты, молекулы-переносчики. Таким образом, Na-каналы утечки обеспечивают вторичный транспорт веществ и участие Na в формировании мембранного потенциала.
Каналы для Са2+:
а) медленные кальциевые потенциалчувствительные каналы (новое название:L-типа), медленно активирующиеся при деполяризации клеточной мембраны, обусловливают медленный входСа2+ в клетку и медленный кальциевый потенциал, например, у кардиомиоцитов. Имеются в исчерченных и гладких мышцах, в нейронах ЦНС;
б) быстрые кальциевые потенциалчувствительные каналы саркоплазматического ретикулума обеспечивают выход Са2+ в гиалоплазму и электромеханическое сопряжение.
Каналы для Cl- имеются в скелетных и сердечных миоцитах, эритроцитах, в небольшом количестве в нейронах и сконцентрированы в синапсах. Потенциалуправляемые С1-каналы имеются в кардиомиоцитах, рецепторуправляемые — в синапсах ЦНС и активируются тормозными медиаторами ГАМ К и глицином.
Дата добавления: 2015-07-07; просмотров: 16264;
