Напряжение циклов, конформации.
В алициклическом ряду существенное значение имеет поворотная изомерия. При этом устойчивость конформеров алициклических соединений определяется напряжением цикла. Различают четыре вида напряжений, обусловленных особенностью циклического строения молекул:
1. Искажение валентных углов или Байеровское напряжение.
2. Торсионное напряжение, связанное с отклонением от наиболее выгодной заторможенной конформации или Питцеровское напряжение.
3. Трансаннулярное взаимодействие (взаимодействие валентно несвязанных атомов и функциональных групп) или наряжение Прелога.
4. Изменение длин связей.
О напряжении в цикле можно судить по теплоте сгорания циклических соединений. Теплота сгорания, приходящаяся на одну группу СН2, наименьшая для циклогексана. Если напряжение в этом цикле принять за нуль, то, например, в трехчленном цикле оно составит 38.1 кДж на одну группу СН2, а пятичленном – 5.4 кДж . В циклах с числом атомов больше шести энергия напряжения, приходящаяся на одну группу СН2 составлдяет 0 – 6 кДж.
Судя по приведенным данным термохимии напряжение, наиболее ярко выражено для молекулы циклопропана. Циклопропан имеет плоский углеродный скелет (три точки всегда лежат в одной плоскости), поэтому атомы водорода находятся в энергетически невыгодном заслоненном положении:
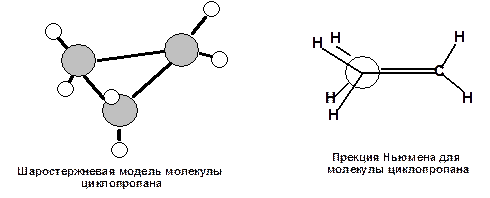
Схема 9. Шаростержневая модель и проекция Ньюмена для молекулы циклопраопана.
В молекуле циклопропана ввалентные углы С-С-С составляют 600, а валентные углы Н-С-Н составляют 1180. Значения валентных углов показывают, что гибридные орбитали атомов углерода не равноценны. Две орбитали, образующие связи С-Н, имеют больший s-характер, чем обычная sp3–орбиталь, а две орбитали, образующие связи С-С, имеют характер больший p-характер. Это делает их похожими на p–орбитали. Если sp3–орбитали в обычных связях С-С перекрываются по прямой, соединяющей ядра атомов, то в циклопропане перекрывание орбиталей происходит с некоторым отклонением от прямой. В результате связи С-С оказываются изогнутыми, их называют «банановыми связями» или τ-связями:
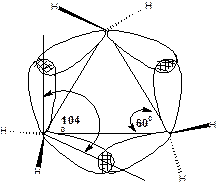
Схема 10. Модель банановых связей в молекуле циклопропана.
Валентный угол между τ-связями около 1040. По своему характеру τ-связи занимают промежуточное положение между σ и π-связями, поэтому в некоторых реакциях циклопропан проявляет свойства ненасыщенного соединения.
Циклобутан также относится к напряженным циклам, хотя угловое напряжение в нем значительно меньше, чем в циклопропане. Четырехчленный цикл устойчивее трехчленного. Торсионное напряжение в циклобутане уменьшается за счет неплоской конформации, в которой молекула представляет собой слегка «согнутый» по диагонали квадрат (угол сгиба составляет около 300). Для монозамещенных циклобутанов возможно существование конформеров, незначительно различающихся по энергии.
В циклопентане, если его представить в виде плоского цикла - валентные углы составили бы 1080, что незначительно отличается от нормального угла 109,50.. Однако, при отсутствии углового напряжения в плоском циклопентане проявляется торсионное напряжение, которое уменьшается при переходе цикла в неплоские конформации. Более устойчивой является твист-конформация (от англ. twist - скрученный), в которой три атома углерода располагаются в плоскости, а два других - над и под плоскостью. Менее устойчива конформация конверта, когда в плоскости лежат четыре атома, а пятый находится над или под плоскостью. Энергетические различия в конформациях циклопентана невелики, поэтому все атомы поочередно выходят из плоскости, в результате чего цикл находится в непрерывном волнообразном движении.
В молекуле циклогексана могут быть сохранены обычные валентные углы при условии его существования в неплоских конформациях «кресла» и «ванны». Конформация «кресла» на 20,9 кДж/моль менее напряжена. Поэтому циклогексан существует преимущественно в виде двух предельных конформеров «кресло». Причем цикл претерпевает непрерывную инверсию с промежуточным возникновением конформации «ванна»:
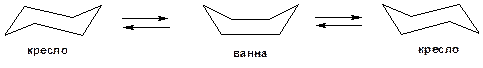
Схема 11. Конформационные модели молекулы циклогексана.
В конформации «кресло» 12 связей С-Н разделяются на две группы. Шесть связей направлены радиально от цикла к периферии молекулы. Эти связи называются экваториальными и обозначаются символом «е». Остальные шесть связей направлены строго параллельно друг-другу и оси симметрии третьего порядка. Эти связи называются аксиальные и обозначаются символом «а». Три из них направлены в одну сторону от плоскости цикла, а три – в другую, причем имеет место чередование:
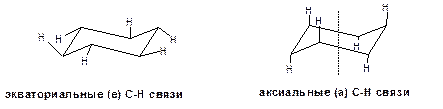
Схема 12. Экваториальные «е» и аксиальные «а» С-Н связи молекулы циклогексана.
Если один из атомов водорода заместить какой-либо группой, например, метильной, то заместитель в циклогексане может занять либо аксиальное, либо экваториальное положение. Исследования физическими методами показали, что если возможен выбор, то заместитель неизменно становится в экваториальное положение:

Схема 13. Экваториальное и аксиальное положения заместителя в молекуле циклогексана.
Это не означает, что с появлением заместителя прекращается инверсия цикла. В случае метилциклогексаена инверсия происходит со скоростью 106 качаний в 1секунду. Но в равновесии преобладает экваториальная форма, так как в этом случае меньше пространственные затруднения.
Дата добавления: 2015-08-01; просмотров: 1359;
