Ентропія
Під час розгляду першого закону термодинаміки (3.1) ми виявили, що лише зміна внутрішньої енергії dU є повним диференціалом. Це зумовлено тим, що внутрішня енергія – це функція стану термодинамічної системи, яка не залежить від способу переходу системи зі стану 1 у стан 2. Крім того, термодинаміка оперує іншими термодинамічними функціями, які є функціями стану системи. Одна з них – ентропія S.
Спробуємо, скориставшись (3.1) та (3.12), виділити один повний диференціал функції, що залежить від макропараметрів ідеального газу:
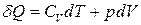 . (3.51)
. (3.51)
Поділимо (3.51) на Т, отримаємо
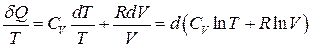 . (3.52)
. (3.52)
Як бачимо, праворуч у рівнянні (3.52) маємо повний диференціал, отже, і ліва частина рівняння повинна бути повним диференціалом. Функцію стану, повним диференціалом якої є 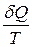 , називають ентропією S, отже,
, називають ентропією S, отже,
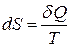 . (3.53)
. (3.53)
Фізичний зміст ентропії виражає формула Больцмана
S=к·lnW, (3.54)
де W – термодинамічна ймовірність.
Термодинамічна ймовірність W – це кількість мікростанів, які зумовлюють заданий макростан системи. На відміну від математичної ймовірності, яка не може бути більшою від одиниці, W може набувати будь-яких додатних значень.
Отже, ентропія S визначена логарифмом кількості мікростанів системи, за допомогою яких може бути реалізовано цей мікростан.
Ентропія має ще й статистичне тлумачення – вона є мірою розупорядкованості системи. Справді, зі збільшенням упорядкованості частинок системи кількість мікростанів зменшується, отже, зменшується й ентропія. Якщо система перебуває в стані термодинамічної рівноваги, то кількість мікростанів максимальна, отже, максимальною є ентропія системи.
З урахуванням ентропії рівняння (3.51) для оборотних процесів можна записати так:
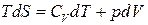 . (3.55)
. (3.55)
Це головна термодинамічна тотожність.
Для характеристики різноманітних термодинамічних процесів важли-вою є не ентропія системи, а її зміна. Щоб обчислити зміну ентропії у певному процесі, скористаємось (3.55):
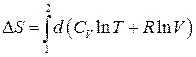 . (3.56)
. (3.56)
1. Ізотермічний процес:
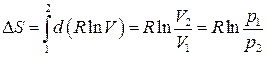 . (3.57)
. (3.57)
2. Ізохорний процес:
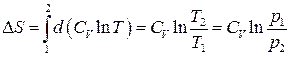 . (3.58)
. (3.58)
3. Ізобарний процес:
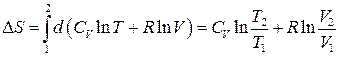 , (3.59)
, (3.59)
однак 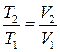 , тоді
, тоді
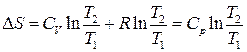 . (3.60)
. (3.60)
4. Адіабатний процес:
ΔS=0, оскільки δQ=0.
Отже, адіабатний процес є ізоентропійним.
Зміна ентропії в необоротних процесах.Розглянемо зміну ентропії під час вирівнювання температури двох тіл, які перебувають у тепловому контакті. Нехай температура першого тіла Т1, а другого – Т2. Після контакту температура обох тіл Т3. Щоб визначити цю температуру скористаємось рівнянням теплового балансу
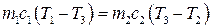 , (3.61)
, (3.61)
звідки
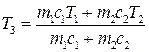 . (3.62)
. (3.62)
Тут m i c – маса і питома теплоємність кожного тіла.
Зміну ентропії в цьому нерівноважному процесі можна обчислити, звівши його до двох рівноважних процесів. Тоді
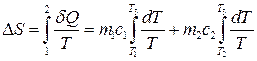 ,
,
звідки
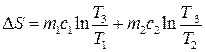 , (3.63)
, (3.63)
Підставимо у (3.62) і (3.63), і переконаємось, що ΔS>0, тобто під час теплопередавання ентропія зростає.
Необоротними є також фазові переходи першого роду. Під час таких процесів зміну ентропії системи виражає формула
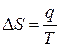 , (3.64)
, (3.64)
де q – питома теплота; Т – температура фазового переходу.
Дата добавления: 2015-07-22; просмотров: 726;
