ПРИЛОЖЕНИЕ. Стандартные окислительно-востановительные потенциалы Электродный процесс Е0, В Mg2+ + 2e=Mg -2,363 Be2+ + 2e= Be -1,847
Таблица I
Стандартные окислительно-востановительные потенциалы
| Электродный процесс | Е0, В |
| Mg2+ + 2e=Mg | -2,363 |
| Be2+ + 2e= Be | -1,847 |
| Al3+ + 3e= Al | -1,663 |
| Ti2+ + 2e = Ti | -1,630 |
| Mn2+ + 2e=Mn | -1,179 |
| Cr2+ + 2e=Cr | -0,913 |
| Zn2+ + 2e=Zn | -0,763 |
| Cr3+ + 3e= Cr | -0,744 |
| Fe2+ + 2e= Fe | -0,44 |
| Cd2+ + 2e= Cd | -0,403 |
| Co2+ + 2e=Co | -0,277 |
| Ni2+ + 2e= Ni | -0,25 |
| Mo3+ + 3e= Mo | -0,200 |
| Sn2+ + 2e= Sn | -0,136 |
| Pb2+ + 2e= Pb | -0,126 |
| Fe3+ + 3e= Fe | -0,037 |
| H+ + e= 1/2H2 | 0,00 |
| Cu2+ + 2e= Cu | +0,337 |
| Ag+ + e = Ag | +0,799 |
| Hg2+ + 2e= Hg | +0,854 |
| Pt2+ + 2e= Pt | +1,20 |
| Au3+ + 3e = Au | +1,498 |
| Au+ + e = Au | +1,691 |
Таблица 2
Равновесные потенциалы водородного и кислородного электродов при разных значениях рН
| Электродный процесс | Е0, В |
| 2H2O + 2е = Н2 + 2 OH- (рН=14) | -0,82 |
| 2H2O + 2е = Н2 + 2 OH- (рН=7) | -0,41 |
| 2H+ + 2e= H2 (pH= 0) | 0,00 |
| O2 +2H2O + 4е = 4OH- (рН=14) | +0,413 |
| O2 + 4H+ + 4е = 2H2O (рН=7) | +0,815 |
| O2 + 4H+ + 4е = 2H2O (рН=0) | +1,23 |
Таблица 3
Перенапряжение реакций выделения водорода и кислорода
| Материал электрода | η н2, В | Материал электрода | η н2, В |
| Pb Hg Cd Zn Sn Al C Ag | 1,56 1,41 1,40 1,24 1,20 1,00 0,78 0,95 | Cu Fe Ni Co Au Pd Pt | 0,87 0,70 0,63 0,62 0,40 0,24 0,10 |
Варианты домашних заданий
| № вар | № задач | № вар. | № задач | № вар. | № задач |
| 1 | 1, 20, 39, 58 | 8 | 8, 27, 46, 65 | 15 | 15, 34, 53, 72 |
| 2 | 2, 21, 40, 59 | 9 | 9, 28, 47, 66 | 16, 35, 54,73 | |
| 3 | 3, 22, 41, 60 | 10 | 10, 29, 48, 67 | 17,36,55, 74 | |
| 4 | 4, 23, 42, 61 | 11 | 11, 30, 49, 68 | 18, 37, 56, 75 | |
| 5 | 5, 24, 43, 62 | 12 | 12, 31, 50, 69 | 19, 38, 57, 76 | |
| 6 | 6, 25, 44, 63 | 13 | 13, 32, 51, 70 | ||
| 7 | 7, 26, 45, 64 | 14 | 14, 33, 52, 71 |
(-) А (α-Fe): Fe – 2e → Fe2+ PH<7
(+)K (Fe3C): 2H+ + 2e → H2
∑ Fe +2H+ → Fe2+ + H2
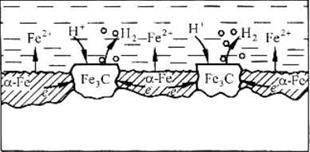
а)
(-) А (α-Fe): Fe – 2e → Fe2+ 2 PH≥7
(+)K (Fe3C): O2 + 2H2O + 4e → 4OH- 1
+O2
∑ 2Fe + O2 + 2H2O → 2Fe(OH)2 → mFexOy•nH2O
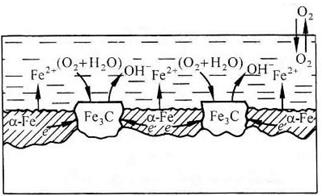
б)
Рис.4. Схема коррозионного разрушения стали с водородной (а) и
Дата добавления: 2015-07-22; просмотров: 1943;
