Концентрация лекарственного средства в плазме крови — ориентир для проведения терапии
Оптимальной индивидуализации лечения помогает измерение концентраций определенных лекарственных средств в плазме крови. Совместное действие генетически детерминированных особенностей выведения, взаимодействия лекарственных препаратов друг с другом, нарушения процессов выведения и распределения, а также других факторов обусловливает наличие широкого диапазона уровней содержания лекарственного средства в плазме крови у разных больных при введении им одной и той же его дозы. Несоблюдение предписанных дозовых режимов во время длительного лечения является эндемической и трудноуловимой причиной неэффективного лечения (см. ниже). Дозу некоторых лекарственных средств в желательных пределах помогают определить клинические признаки, и никакое химическое исследование не может заменить тщательное наблюдение за реакцией больного на лечение. Однако лечебные и сопутствующие нежелательные эффекты невозможно точно определить в количественном отношении для всех лекарственных средств, и в сложных клинических ситуациях можно дать неверную оценку действию лекарственного препарата. Например, существовавшее ранее неврологическое заболевание может замаскировать неврологические последствия интоксикации фенитоином. Поскольку клиренс, период полувыведения, накопление и уровни содержания лекарственного вещества в организме трудно прогнозировать, то измерение концентрации его в плазме крови часто оказывается полезным ориентиром для определения оптимальной дозы препарата. Это особенно справедливо в тех случаях, когда диапазон значений уровней содержания лекарственного средства, обеспечивающих лечебное действие, и уровней, вызывающих неблагоприятные эффекты, достаточно узок. Для лекарственных средств, имеющих именно такие характеристики, как, например, дигоксин, теофиллин, лидокаин, аминогликозиды и противосудорожные средства, разработаны многочисленные методы их дозировки с целью улучшения соотношения между дозой препарата, концентрацией его в плазме крови и реакцией. Некоторые из этих методов точны и полезны, как, например, метод обратной связи Bayesian, тогда как другие недостаточно точны или обоснованы. Необходимы дальнейшие исследования эффективности этих методов, чтобы установить их место в повседневной практике ухода за больным.
Необходимо определить вариабельность реакций на определенные уровни содержания лекарственных препаратов в плазме крови у разных людей. Это проиллюстрировано кривой доза — эффект для гипотетической популяции (рис. 64-5) и ее взаимосвязью с лечебным диапазоном доз, или терапевтическим окном желательных концентраций лекарственного средства. Определенное терапевтическое «окно» должно включать в себя такие уровни содержания препарата в плазме крови, которые обеспечивали бы желаемый фармакологический эффект у большинства больных. Сложность заключается в том, что одни люди настолько чувствительны к лечебному действию большинства лекарственных средств, что реагируют на низкие уровни их содержания в организме, тогда как другие до такой степени невосприимчивы, что желаемый лечебный эффект обеспечивается чрезмерно высокими дозами лекарственного препарата, что создает вероятность неблагоприятных воздействий. Например, некоторым больным с обширным судорожным очагом для контролирования судорожных припадков необходимы концентрации фенитоина в плазме крови, превышающие 20 мкг/мл, что достигается применением соответствующих, достаточно больших, доз препарата.
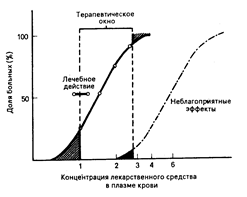
Рис. 64-5. Вариабельность реакций на определенные уровни содержания лекарственных препаратов в плазме крови у разных людей.
Представлена совокупная процентная доля больных, у которых возрастающие уровни содержания лекарственного средства в плазме крови оказывают как лечебное действие, так и вызывают неблагоприятные эффекты. Терапевтическое окно определяет диапазон таких концентраций лекарственного средства, которые будут обеспечивать достижение лечебного эффекта у большинства больных и вызывать неблагоприятные эффекты у меньшинства.
В табл. 64-4 приведены концентрации некоторых лекарственных средств в плазме крови, обеспечивающие лечебное воздействие и приводящие к возможному развитию неблагоприятных эффектов у большинства больных. Использование этой таблицы в свете рассмотренных выше ориентиров должно способствовать более результативному и безопасному лечению тех больных, которые выпадают из разряда «усредненных».
Участие больного в программах лечения. Измерение концентрации лекарственного средства в плазме крови является наиболее эффективным способом контроля за соблюдением больным медикаментозного режима. Подобная проблема чаще всего возникает в случае долгосрочного лечения таких заболеваний, как гипертония и эпилепсия, и отмечается более чем у 25% больных в случае отсутствия целенаправленных усилий на развитие у человека чувства собственной ответственности за состояние своего здоровья. Иногда подобное несоблюдение режима лекарственной терапии может быть обнаружено путем сочувственного, не носящего обвинительного характера опроса больного, но чаще оно выявляется только после установления того, что концентрация лекарственного средства в плазме крови недопустимо низка или равна нулю. В таких случаях целесообразно сравнить, уровень содержания лекарственного вещества на момент исследования с полученными у этого больного во время нахождения его на лечении в стационаре, чтобы убедиться в том, что несоблюдение режима лекарственной терапии действительно имеет место. После того как врач убедится в нарушении больным предписанного режима лечения, проведение доброжелательного и спокойного обсуждения этой проблемы с больным поможет прояснить причину такого поведения и послужит основой для более деятельного участия больного в дальнейшем лечении. Было опробовано много различных подходов с целью повысить у больного чувство ответственности за состояние своего здоровья; большинство из них основано на сообщении больному более детальной информации относительно характера его заболевания и ожидаемых результатов как в случае успешного лечения, так и в случае неудачи, связанной с его прекращением. Больному следует разъяснить различные проблемы, связанные с лечением и его результатами. Целесообразно максимально упростить режим лекарственной, терапии как в отношении количества назначаемых лекарственных препаратов, так и частоты их введения. Обучение больных тому, чтобы они приняли как должное важность их собственной роли в заботе о своем здоровье, требует сочетания медицинского искусства с медицинской наукой.
Таблица 64-4. Концентрации лекарственных средств в плазме крови: взаимосвязь с лечебным воздействием и неблагоприятными эффектами
| Лекарственное средство | Лечебное воздействие3 | Неблагоприятные эффекты6 |
| Амикацин | 20 мкг/мл | 40 мкг/мл |
| Карбенициллина динатриевая соль | 100 мкг/мл" | 300 мкг/мл |
| Карбамазепин | 3 мкг/мл | 10 мкг/мл |
| Дигитоксин | 12 нг/мл | 25—30 нг/мл |
| Дигоксин | 0,8 нг/мл | 2,0 нг/мл |
| Этосукцимид | 40 мкг/мл | 100 мкг/мл |
| Гентамицин | 4 мкг/мл' | 12 мкг/мл |
| Лидокаин | 1,5 мкг/мл | 5 мкг/мл |
| Литий | 0,5 ммоль/л | 1,3 ммоль/л |
| Пенициллин G | 1 —25 мкг/мл'1 | |
| Фенитоин (дифенилхидантоин) | 10 мкг/мл | 20 мкг/мл |
| Новокаинамид | 4 мкг/мл | 8 мкг/мл |
| Хинидин | 2,5 мкг/мл | 6 мкг/мл |
| Теофиллин | 8 мкг/мл | 20 мкг/мл |
' Лечебное воздействие при уровнях содержания ниже приведенных регистрируется редко или является очень слабым.
Частота развития неблагоприятных эффектов резко возрастает при превышении этих концентраций.
Минимальная подавляющая концентрация (МПК) для большинства штаммов Pseudomonas aeruginosa. МПК для других, более чувствительных микроорганизмов будут меньше приведенной.
Зависит от МПК. Более высокие концентрации (до 8 мкг/мл) могут быть желательны в случае нарушенных защитных механизмов организма хозяина. Существует широкий диапазон МПК пенициллина для различных микроорганизмов, а МПК для всех тех микроорганизмов, против которых применяется пенициллин, составляет <20. Массированная терапия пенициллином в дозе 20 000 000 ЕД в сутки приводит к концентрации его в плазме крови, равной 20—25 мкг/мл у больных с клиренсом креатинина 100 мл/мин.
Дата добавления: 2015-07-22; просмотров: 2345;
