ГЛАВА 3. ПАТОФИЗИОЛОГИЧЕСКИЕ АСПЕКТЫ И МЕДИЦИНСКАЯ ПОМОЩЬ
Реймонд Мациевич, Джозеф Б. Мартин (Raymond Maciewicz, Joseph В. Martin)
Боль относится к наиболее распространенным субъективным признакам болезни. Хотя в каждом случае природа, локализация и этиология боли различны, почти половину всех больных, обращающихся к врачу, прежде всего беспокоит боль. Правильное лечение больных с очевидным ограниченным болезненным процессом (например, переломом кости) в большинстве случаев облегчает боль. У многих больных болевой синдром требует, однако, тщательного исследования и оценки, прежде чем будет выяснена его причина и определен подход к лечению. У некоторых больных причину боли установить не удается. Стоимость медицинской помощи больным с хроническим болевым синдромом ежегодно превышает 50 млрд долларов, а одна лишь боль в нижней части спины каждый год приводит к потере 100 млн рабочих дней. Поэтому хроническая боль является не только важной медицинской проблемой, но также и социальной.
Обследование пациента с жалобами на боль. часто бывает затруднено, поскольку боль — восприятие, а не ощущение. Физическое состояние человека, прошлые воспоминания о боли и ее предчувствие — все это влияет на восприятие пациентом боли. Например, солдаты и спортсмены могут отрицать боль, несмотря на наличие острой травмы, а некоторые больные с хроническим болевым синдромом могут продолжать испытывать боль, несмотря на отсутствие очевидного болевого раздражителя. Наши представления о боли и большинство способов ее устранения направлены на подавление болевой чувствительности; однако интерпретация больным чувства боли, эмоциональная реакция и поведение являются в равной мере важными факторами, которые заслуживают пристального внимания врача.
Организация болевых путей. Болевые афферентные пути. Чувствительные раздражители такой интенсивности, которая потенциально повреждает ткань, возбуждают свободные нервные окончания, расположенные в коже, в подлежащих тканях и во внутренних органах. Болевые импульсы передаются в спинной мозг немиелинизированными и слабо миелинизированными чувствительными аксонами. Возбуждение небольших отдельных чувствительных аксонов может вызвать у человека болевой ответ в участке кожи, иннервируемом этим волокном, ясно показывая, что в некоторых условиях даже единичные аксоны могут передавать возбуждение, которое воспринимается мозгом как «боль».
Многие немиелинизированные болевые афферентные пути характеризуются «полимодальными» (множественными) реакциями. Такие волокна могут возбуждаться под действием сильного механического раздражителя, способного повреждать ткань, и химических раздражающих веществ, введенных внутрикожно. Любое интенсивное раздражение здоровой кожи может вызвать «тройной ответ», который заключается во внезапном покраснении кожи в области раздражения, в покраснении окружающей ткани, обусловленном расширением артерий, и в локальном отеке, вызванном увеличением проницаемости сосудов. Вероятно, эта реакция обусловлена многими факторами. Некоторые соединения освобождаются поврежденной тканью (калий, гистамин, серотонин, простагландины), другие поступают из циркуляторного русла (брадикинин) или непосредственно от самих нервных окончаний (субстанция Р). Некоторые из этих веществ также возбуждают свободные нервные окончания, их длительным воздействием отчасти можно объяснить гиперчувствительность кожи, которая часто развивается за повреждающим воздействием.
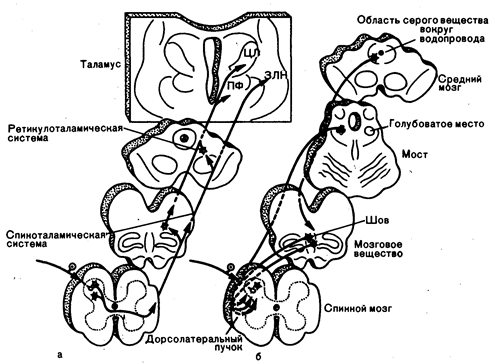
Рис. 3.1. Восходящие (а) и нисходящие (б) болевые пути.
Прямой спиноталамический путь заканчивается в заднелатеральном нижнем ядре (ЗЛН). Непрямой спиноталамический путь проходит через ретикулярную формацию ствола мозга и заканчивается в ядрах медиального и интраламинарного таламуса: парафасцикулярном (ПФ) и центральном латеральном (ЦЛ). Нейроны области водопровода мозга проецируются в ядро шва, откуда начинаются нисходящие пути, подавляющие болевую чувствительность задних рогов спинного мозга. Самостоятельный тормозящий путь ядра голубоватого места также оканчивается в задних рогах.
Задние рога спинного мозга. От клеток, локализованных в ганглиях задних корешков сегментов спинного мозга, в дистальном и проксимальном направлениях отходят чувствительные волокна. Болевые афферентные пути входят в спинной мозг через задний корешок и оканчиваются на нейронах задних рогов (рис. 3—1,а). Многие мелкие афферентные окончания этой области содержат нейропептиды, в том числе субстанцию Р, холецистокинин и соматостатин. Появляются все новые данные, говорящие о том, что эти пептиды играют важную роль в нормальной передаче чувствительного возбуждения. У животных химическое разрушение волокон, содержащих субстанцию Р, приводит к утрате болевой чувствительности (аналгезия), что определяется некоторыми тестами; наблюдается также заметное снижение интенсивности окрашивания на субстанцию Р в концевых нейронах задних рогов спинного мозга у больных с врожденными нейропатиями, характеризующимися уменьшением чувствительности к боли.
На основании морфологии клеток и их расположения задние рога спинного мозга можно разделить на ряд слоев. В некоторых из этих слоев обнаружены нейроны, которые перерабатывают болевую информацию. Выходящие нейроны, которые проецируются на мозговой ствол и зрительный бугор, найдены в основном в слоях I и V, т. е. в зонах, в которых оканчиваются многие тонкие афферентные пути. Аксоны этих нейронов задних рогов спинного мозга образуют перекрестный путь, который поднимается в вентролатеральный квадрант спинного мозга, т. е. образует спиноталамический путь.
Спиноталамическая система. Аксоны болевых нейронов задних рогов, которые образуют спиноталамические пути, оканчиваются в нескольких ядрах ствола мозга и зрительного бугра. Спиноталамический путь можно схематично разделить на две системы на основании их связей: прямую спиноталамическую систему, которая несет чувствительную распознающую боль информацию в зрительный бугор, и филогенетически более древнюю спиноретикулоталамическую систему, которая оканчивается более диффузно в ретикулярных ядрах ствола мозга.
Прямая спиноталамическая система, которая оканчивается в зрительном бугре, играет, возможно, важную роль в осознанном восприятии болевых ощущений. Эта система оканчивается в заднелатеральном нижнем ядре. Концевой отдел спиноталамического пути в заднелатеральном нижнем ядре перекрывает задний столбчато-медиальный лемниековый путь поступления информации, ответственный за легкое прикосновение и общую чувствительность. Организованная таким образом структура окончаний и конвергенция тактильных и болевых сигналов внутри заднелатерального нижнего ядра может оказать существенное влияние на распознавание чувства боли, включая ее локализацию, природу и интенсивность повреждающего раздражителя. В соответствии с этой точкой зрения клетки заднелатерального нижнего ядра проецируются в основном на первичную соматочувствительную область коры головного мозга.
Более диффузная спиноретикулоталамическая система может опосредовать различные виды вегетативных и эмоциональных реакций на боль. Восходящие спиноретикулярные волокна оканчиваются на нескольких уровнях ретикулярной формации ствола мозга, образуя часть полисинаптической системы, которая оканчивается в медиальных ядрах таламуса (центральное латеральное и парафасцикулярное ядра). На всем протяжении спиноретикулоталамической системы клетки имеют большие, билатеральные чувствительные воспринимающие поля, которые могут включать всю поверхность тела. Часто эти клетки лучше всего реагируют на чувствительные повреждающие раздражения. Маловероятно, что такие клетки важны для распознавания чувствительности или ее локализации; они, вероятно, имеют существенное значение для возбуждения или для ориентации к болевому раздражителю.
Вероятно, в обычных условиях существует равновесие между точной, специфичной информацией, поступающей через заднелатеральное нижнее ядро, и более общими сигналами тревоги, передаваемыми через медиальный таламус. Клинически выявляемые расстройства, при которых частично разрушена боковая область зрительного бугра, включая заднелатеральное нижнее ядро, могут приводить к синдрому продолжительной жгучей боли, затрагивающему и противоположную сторону тела (таламический синдром Дежерина—Русси); боль часто имеет усиливающий ее эмоциональный или вегетативный компонент. Это состояние может быть обусловлено неограниченным прохождением чувствительной информации через срединную часть зрительного бугра, что воспринимается головным мозгом как боль. Это соответствует тому факту, что у некоторых больных хирургические повреждения срединной части зрительного бугра могут уменьшать этот тип продолжительной боли центрального происхождения.
Нисходящие болевые пути. В дополнение к описанным основным восходящим болевым путям в головном мозге содержатся мощные нисходящие пути, которые подавляют болевую чувствительность (рис. 3—1, б). Электрическое раздражение серого вещества среднего мозга в области водопровода у животных может вызвать генерализованную утрату чувствительности к боли без других явных чувствительных или двигательных реакций. Подобная картина может на блюдаться у человека, поскольку установлено, что раздражение серого вещества, расположенного в непосредственной близости вокруг желудочка мозга, уменьшает клинические проявления боли. Вероятно, это действие, по крайней мере частично. опосредуется на уровне спинного мозга, поскольку оно может быть блокировано у животных перерезкой путей, которые несут нисходящие импульсы от- ствола мозга в задние рога. Однако небольшое число клеток серого вещества, расположенного вокруг водопровода, проецируется непосредственно в спинной мозг. Нисходящий путь, ответственный за утрату болевой чувствительности, наоборот, появляется на уровне первого синапса в ядрах срединного шва продолговатого мозга (главным образом nucleus raphe magnus). Нейроны шва в свою очередь проецируются в спинной мозг, где они подавляют болевую реакцию нейронов задних рогов. Эта нисходящая система может потенциально перекрывать поток болевой чувствительности от уровня первого синапса в задних рогах.
Серое вещество, расположенное вокруг водопровода, борозда продолговатого мозга и задние рога спинного мозга содержат много эндогенных опиатных пептидов и опиатных рецепторов. Системные наркотические болеутоляющие средства могут, в частности, действовать путем возбуждения этих центров- нисходящей болеутоляющей системы. Высокая плотность опиатных рецепторов обнаружена также в срединной части зрительного бугра и в лимбической системе переднего мозга; эти структуры могут играть дополнительную важную роль в болеутоляющем ответе на систематически вводимые наркотики и в механизме привыкания к ним.
Другой класс нейромедиаторов, обнаруженных в нисходящих путях, представляют биогенные амины, которые изменяют характер восприятия боли. Во многих нейронах борозды, которые оканчиваются в задних рогах спинного мозга, содержат серотонин, и серотонинергические окончания некоторых аксонов оканчиваются непосредственно на нейронах спиноталамического пути. Основной нисходящий подавляющий болевую чувствительность-путь, содержащий норадреналин. также начинается в ядре голубоватого места варолиева моста; вероятно, эта система подавляет болевые реакции нейронов заднего рога с участием альфа-адренергических механизмов. Такие лекарственные вещества, как трициклические антидспрессанты, которые усиливают влияние биогенных аминов на центральную нервную систему, могут служить эффективными болеутоляющими средствами, действие которых заключается в активации реакций этих нисходящих путей.
Обследование больных с болевым синдромом. Соматическая боль. Боль обычно возникает тогда, когда потенциально повреждающий ткань раздражитель возбуждает периферические болевые афферентные волокна. Когда повреждающий раздражитель возбуждает рецепторы в коже, мышце или в суставе, возникающая соматическая боль обычно четко локализована и легко описывается больным (табл. 3.1). Напротив, боль висцерального происхождения часто имеет нечеткую локализацию и может иррадиировать в области на поверхности тела, которые снабжаются теми же самыми чувствительными корешками, что и пораженный внутренний орган. Например, миокардиальная боль возбуждает афферентные пути внутренних органов, оканчивающиеся в верхних четырех грудных сегментах спинного мозга. Эти болевые импульсы сходятся на тех же нейронах, куда поступает информация от ti—TIV дерматомов кожи, и поступившие болевые импульсы часто отражаются в этот участок здоровой в других отношениях кожи или же в подлежащие ткани. Висцеральная боль, возникшая в желчном пузыре или в почках, будет подобным образом отражаться в соответствующий дерматом.
Таблица 3.1. Сравнительная характеристика соматической и нейропатической боли
| Соматическая боль | Нейропатическая боль |
| 1. Болевой раздражитель, обычно очевиден | 1, Болевой раздражитель не определяется |
| 2. Боль обычно хорошо локализована; может отражаться в другие органы | 2. Боль часто плохо локализована |
| 3. Боль напоминает больному эпизоды боли, перенесенные им раньше | 3. Боль носит необычный характер, отличный от соматической боли |
| 4. Боль уменьшается под действием противовоспалительных средств и наркотических анальгетиков | 4. Боль лишь частично поддается действию наркотических анальгетиков |
Как кожная, так и висцеральная боль встречается довольно часто и не всегда является признаком болезненного процесса. Соматическая боль, возникающая в результате нового повреждения или заболевания, обычно привычна больному и описывается им в контексте прежних болевых ощущений. Соматическая боль, обусловленная возбуждением обычных механизмов боли, очень часто эффективно снимается коротким курсом лечения подходящим болеутоляющим средством.
Нейропатическая боль. Боль может также возникать в результате повреждения или хронических изменений соматочувствительных путей периферической или центральной нервной, систем.. Это может быть обусловлено индуцированным необычным характером возбуждения афферентных нейронов, которое достигает задних рогов спинного мозга и более отдаленных структур центральной нервной системы. Повреждение чувствительных путей может также уменьшить болеутоляющие регуляторные реакции, которые в обычных условиях активируются поступлением периферических импульсов. Нейропатическая боль, которая следует за повреждением чувствительных путей, может развиваться и сохраняться при отсутствии явного первичного болевого раздражителя. В отличие от большинства соматических болей Нейропатическая боль часто плохо локализована. Больной.часто использует образные описания, чтобы охарактеризовать эту боль, подчеркивая различие между восприятием обычных соматических болей и нейропатическими ощущениями (см. табл. 3.1).
Нарушения чувствительности при нейропатической боли могут быть либо очаговыми, либо более генерализованными. Травма или воспаление периферического нерва могут привести к невралгии, которая определяется как боль, распространяющаяся по единичному нерву; эта боль часто (но не всегда) сопровождается такими признаками, как утрата чувствительности- или снижение мышечного тонуса в области, иннервируемой этим нервом. Часто болевой синдром за ключается в постоянном ощущении жгучей или продолжительной тупой, но не интенсивной боли (дизестезия), которая может чередоваться с приступами острой боли внутри пораженной области. Вопреки увеличению порога чувствительности у больных часто проявляется гиперреакция на болевой раздражитель (гипералгезия) или на прикосновение (гиперэстезия), а также восприятие неболевого раздражения как болевого (аллодиния). Эти понятия, используемые для обозначения гиперчувствительности, обычно объединяют термином гиперпатия.
При некоторых формах невралгии (таких, как невралгия тройничного нерва) преобладает приступообразная, режущая боль при отсутствии других объективных признаков дисфункции нервной системы. Напротив, каузалгия, следующая за повреждением нерва, характеризуется продолжительной тяжелой жгучей болью, аллодинией и нарушениями со стороны симпатической нервной системы. Боль может также быть характерной чертой более генерализованных нейропатий, связанных с дегенерацией тонких аксонов. В таких случаях может иметь место как множественная локализация боли, так и разнообразие типов боли. При диффузных чувствительных или чувствительно-двигательных нейропатиях боль обычно возникает симметрично и в дистальных отделах, поражая стопы ног и при прогрессировании заболевания кисти рук. Как и при более ограниченных невралгиях, боль часто носит спонтанный продолжительный, тупой, но неинтенсивный характер или бывает жгучей с накладывающимися на нее судорожными приступами боли. Аллодиния и гипералгезия характерны для острой, мучительной фазы этого заболевания.
Боль может также быть симптомом истощения вслед за повреждением соматочувствительных путей центральной нервной системы. Повреждения нисходящих соматочувствительных путей на уровне спинного мозга, ствола головного мозга, зрительного бугра или коры головного мозга могут привести к синдрому продол жительной спонтанной боли, которая отражается на периферию, часто с накладывающимися на нее нарушениями чувствительности, которые обсуждались выше.
Психологические аспекты боли. У некоторых больных с болевым синдромом, особенно хроническим, часто корреляция между тяжестью действительного заболевания и реакцией на боль выражена слабо. Социальные и психологические факторы могут оказывать существенное влияние на восприятие такими больными болевых раздражителей. Поэтому осмотр психиатром или психологом большинства больных со стойкими жалобами на боль должен быть составной частью клинического обследования. Психологические тесты, включая Миннесотский многостадийный профиль личности, могут помочь в его проведении.
Несколько категорий психологических диагнозов могут наблюдаться у больных с хроническим болевым синдромом. Чаще других встречаются депрессия и соматоформные нарушения.
Депрессия. Симптомы депрессии характерны для больных с хронической болью и обнаруживаются почти в 30% случаев. Многие больные с болевым синдромом отрицают депрессию и не демонстрируют депрессивную эмоциональную реакцию. У таких больных могут наблюдаться вегетативные признаки бессонницы, снижения полового влечения и утрата жизненного тонуса.
Взаимоотношения боли и депрессии довольно сложны. У больных с клинически выраженной депрессией снижается болевой порог, и боль считается обычной жалобой у больных с первичной депрессией. У больных с болевым синдромом, обусловленным хроническим соматически м заболеванием, часто также развивается депрессия. Однако частота депрессии, определенная в соответствии со строгими клиническими критериями, недостоверно различается у больных с хронической болью и у больных без боли.
В попытке более ясно обрисовать отношение между болью и депрессией была описана подгруппа больных с хроническим болевым синдромом и с нарушением, названным «лежащий ничком от боли». Такие больные демонстрируют ипохондрическое отношение к своему состоянию. Боль часто бывает продолжительной по своему характеру и неясной по происхождению. У больного с жалобами на боль могут иметь место следующие симптомы депрессии: бессонница, усталость и отчаяние. В истории болезни пациентов, которые не могут подняться от боли, часто обнаруживаются указания на стресс и неудовлетворенные потребности. В семейном анамнезе могут содержаться сведения о депрессии среди близких родственников, алкоголизме или плохом физическом обращении. Такие люди до развития болевого синдрома имеют, однако, идеализированное мнение о себе и своих семейных отношениях, отрицают конфликты. Они могут заниматься принудительной трудовой деятельностью и несколько раз сменить профессию. Хроническая боль в этой группе лиц отчасти может быть связана с неразрешенными личностными и межличностными конфликтами.
В соответствии с существованием связи между болью и депрессией антидепрессанты могут стабилизировать сон и уменьшать симптомы дисфории у больных с хроническим болевым синдромом. При этом часто уменьшается интенсивность боли, что может сопровождаться снижением потребности в болеутоляющих средствах. Антидепрессанты, таким образом, могут играть важную роль в облегчении хронической боли, хотя еще предстоит выяснить, действуют ли эти лекарственные средства, главным образом потенцируя действие болеутоляющих средств или же уменьшая преклиническую депрессию.
Соматоформные расстройства. У больных с соматоформными расстройствами имеются симптомы, которые наводят на мысль об органном заболевании, но при этом отсутствуют сведения о физическом нарушении, которое могло бы объяснить эти симптомы. Раздел «Соматоформные нарушения» включает описание больных с соматическими нарушениями психогенной природы, расстройствами конверсии, ипохондрией или психогенным болевым синдромом. Хотя симптомы хронической боли часто являются лишь частью картины соматоформного расстройства, больные с этим диагнозом не имеют клинических признаков депрессии и обычно не реагируют на антидепрессанты. Однако такие больные вновь и вновь обращаются к врачам и подвергаются повторным обследованиям, чтобы объяснить неопределенные жалобы. Обычно прописываемые им разнообразные болеутоляющие средства, анксиолитики и миорелаксанты оказываются малоэффективными или же вовсе бесполезными. Часто не имеют успеха также применяемые для уменьшения боли хирургические методы.
Больных с соматоформными нарушениями приходится многократно убеждать, что их боль имеет доброкачественную природу; облегчение этих состояний поэтому носит в основном поддерживающий характер. Этим больным показано внебольничное наблюдение со стороны ограниченного числа добровольно ухаживающих за ними людей, чтобы свести к минимуму ненужные исследования и уменьшить число назначаемых лекарственных средств. В этой группе больных диагностирование новых болей, которые являются признаками истинной патологии органа, может служить признаком появления клинической симптоматики.
Оказание помощи больным с болевым синдромом. Острая соматическая боль обычно эффективно излечивается ненаркотнческими болеутоляющими средствами, которые уменьшают боль, не вызывая изменений сознания (табл. 3.2). Часто эффективными оказываются ацетилсалициловая кислота в дозе от 300 до 600 мг перорально каждые 4 ч или ацетаминофен в дозе 600 мг, также перорально каждые 4 ч. Можно использовать другие нестероидные противовоспалительные средства, включая фенацетин, напроксен, сулиндак или ибупрофен; однако еще недостаточно накоплено доказательств того, что эти лекарственные средства значительно лучше, чем менее дорогие ацетилсалициловая кислота или ацетаминофен. Все нестероидные противовоспалительные средства обладают побочными действиями, вызывая раздражение желудочно-кишечного тракта, и могут привести к аллергическим реакциям. Побочные действия ацетилсалициловой кислоты, особенно диспепсия, желудочно-кишечные кровотечения и подавление агрегации тромбоцитов, не наблюдаются при использовании ацетаминофена; однако ацетаминофен не обладает противовоспалительными свойствами. Комбинация обоих препаратов не более эффективна, чем каждый в отдельности, но любое из них в комбинации с кодеином более эффективен, чем один кодеин.
Таблица 3.2. Лекарственные средства, используемые для лечения болевого синдрома
Ненаркотические болеутоляющие средства: рекомендуемые дозы и интервалы между введением
| Название | Разовая доза, мг | Интервал, ч |
| Ацетилсалициловая кислота | 750—1250 | |
| Фенацетин | 750—1000 | |
| Ацетаминофен | 600—800 | |
| Фенилбутазон | 200—400 | |
| Индометацин | 50—75 | |
| Ибупрофен | 200—400 | |
| Напроксен | 250—500 | |
| Нефопам | 60—120 |
Наркотические болеутоляющие средства в сравнении с 10 мг морфина сульфата
| Название | Внутримышечная доза, мг | Перораль-ная доза, мг | Отличия от морфина сульфата |
| Оксиморфин | Нет различий | ||
| Гидроморфин | 1,5 | 7,5 | Более короткое действие |
| Леворфанол | Высокоэффективен при пероральном и внутримышечном введении | ||
| Героин | Короткое действие при пероральном и внутримышечном введении | ||
| Морфин | |||
| Оксикодон | Короткое действие | ||
| Меперидин | Нет различий | ||
| Пентазоцин | Агонист — антагонист | ||
| Кодеин | Более токсичен | ||
| Антиконвульсанты | |||
| Название | Разовая пероральная доза, мг | Интервал, ч | |
| 6—8 | |||
| Карбамазепин | |||
| Клоназепам | |||
| Название | Пероральная доза, мг | Колебания дозы, мг/24 ч | |
| Доксипин | 75—400 | ||
| Амитриптилин | 75—300 | ||
| Имипрамин | 75—400 | ||
| Нортриптилин | 40—150 | ||
| Дезипрамин | 75—300 | ||
| Амоксапин | 75—300 | ||
| Тразодон | 50—600 |
Для облегчения сильной боли обычно требуются наркотические болеутоляющие средства. Как правило, в течение определенного отрезка времени больных следует лечить только одним наркотическим средством, причем лечение следует начинать препаратом умеренной силы, таким как кодеин в дозе 30 мг каждые 4—6 ч. При пероральном применении кодеин относительно безопасен, обладает сильным действием и хорошо переносится. Однако, если кодеин перорально в дозе 60 мг каждые 4 ч не приносит облегчения, эту попытку необходимо прекратить и заменить кодеин более сильными наркотическими средствами, такими как морфин или меперидин, назначаемые по определенной схеме. Увеличение дозы кодеина выше рекомендованной увеличит частоту возникновения побочных реакций и не повысит болеутоляющий эффект.
Пациентов с болью, обусловленной заболеванием какого-то внутреннего органа, часто лечат такими парентерально вводимыми болеутоляющими наркотическими средствами, как морфин или меперидин по принципу «каждые 6 ч, если необходимо». Эффективная аналгезия при применении таких лекарственных средств обычно длится только 2—3 ч, в связи с чем больной будет вновь испытывать боль к моменту введения следующей дозы. Болеутоляющие средства, используемые по мере необходимости, также редко принимают с предписанной частотой, что приводит к периодам недостаточной аналгезии; эта ситуация усиливает «болевое поведение», потенциально задерживая выздоровление. Недостаточный болеутоляющий эффект у послеоперационных больных уменьшает объем дыхания, что. обусловлено ригидностью мышц при болезненности движений, и задерживает выздоровление. Чтобы облегчить боль. необходимо, когда это показано, назначать болеутоляющие наркотические средства достаточно часто и в достаточно высоких дозах. Лекарственную терапию боли желательно проводить больному, придерживаясь определенного режима, а не по принципу «когда это необходимо», учитывая, что больной может отказаться от лекарственного средства при достаточной степени аналгезии. Больному следует объяснить изменения в дозировке болеутоляющего средства и необходимость постепенно уменьшать дозу наркотика по мере исчезновения острой фазы боли.
Хронические заболевания обычно вызывают повторные приступы боли, а не постоянный дискомфорт. Устранение приступов боли должно проводиться так же, как и лечение вновь возникшей острой боли. Болеутоляющие средства должны использоваться больным в момент приступа при условии, что применение лекарственного средства будет прекращено, когда острый приступ боли пройдет.
Больные с такими заболеваниями в терминальной стадии, как рак с метастазами, часто страдают постоянной или часто повторяющейся острой болью. В этой ситуации важным фактором становится переносимость лекарственной терапии. Чтобы поддержать необходимую степень аналгезии, для таких больных могут быть необходимы увеличенные дозы наркотических болеутоляющих средств, хотя лежащий в основе заболевания патологический процесс остается при этом, по существу, неизмененным. Поскольку доза наркотика увеличивается, частота побочных явлений, включая заторможенность, дисфорические реакции и запор, может также увеличиваться. У отдельных больных в терминальной стадии введение морфина через эпидуральный или подоболочечный катетеры может обеспечить эффективную аналгезию с незначительной побочной реакцией. Для большинства больных, однако, облегчить боль, в то же время сводя к минимуму побочные реакции, часто можно заменой лекарственного средства, изменением дозы или назначением дополнительного болеутоляющего средства.
Помощь при нейропатической боли. Нейропатическая боль часто является причиной хронической нетрудоспособности; эта боль может обусловливаться патофизиологическими изменениями на многих уровнях нервной системы. Возможности лекарственного лечения нейропатической боли, однако, ограничены, у больных редко удается достигнуть выраженного длительного улучшения при использовании одного вида терапии. Общепринятые болеутоляющие средства у больных с нейропатической болью эффективны лишь в редких случаях. Поиск новых способов лечения таких больных привел к появлению большого числа разных подходов.
А н т и к о н в у л ь с а н т ы. Больным с нейропатической болью и слабой или же необнаруженной дисфункцией симпатической нервной системы часто назначают антиконвульсанты и аптидепрессанты, хотя имеются лишь ограниченные данные о том, что лечение этими лекарственными препаратами эффективно.
Для некоторых больных с нейропатиями или невралгиями могут оказаться полезными фенитоин, карбамазепин или клоназепам. Антиконвульсанты особенно эффективны при лечении острых, режущих болей, ассоциирующихся с такими локальными нейропатиями, как невралгия тройничного нерва. Они менее эффективны для лечения постоянной тупой боли, ощущений жжения, которые являются основным компонентом таких состояний, как невралгия после герпетической инфекции или диабетическая нейропатия.
Антисимпатические средства. У некоторых больных травматические невралгии могут проявляться спонтанной жгучей болью и выраженной дисфункцией симпатической нервной системы в пораженной конечности. Это состояние обозначается термином каузалгия и может быть самостоятельной формой дистрофии симпатической нервной системы. При каузалгии изменения чувствительности ассоциируются с нарушением симпатической иннервации в пораженной конечности. Часто десимпатизация путем хирургического вмешательства или блокады с помощью анестетика уменьшает боль при каузалгии, что, по мнению многих исследователей, следует обязательно учитывать при проведении дифференциальной диагностики.
Если боль ослабевает вследствие блокады симпатического нерва, лечение некоторых больных путем внутривенного введения регионарных или системных антисимпатических лекарственных средств, таких, как гуанетидин, может привести к значительному ослаблению боли.
Трициклические антидепрессанты. Для лечения боли, возникающей при повреждении периферического нерва, часто используют антидепрессанты. К наиболее распространенным лекарственным средствам относятся трициклические иминодибензильные производные. Их фармакологическое действие заключается в облегчении проведения нервного импульса, опосредованного моноаминами, путем подавления повторного поглощения медиатора синапсом и изменения чувствительности пре- и постсинаптических адренергических рецепторов. Точка приложения действия трициклических антидепрессантов в механизмах ослабления боли не выяснена. Однако они могут действовать, усиливая подавление в стволе мозга передачи болевого импульса на уровне задних рогов спинного мозга. Трициклические антидепрессанты существенное влияние оказывают также на восходящие аминергические системы, которые проецируются в передний мозг. Представляется вероятным, что эти восходящие системы имеют значение также для восприятия боли, хотя вопрос о том, как антидепрессанты влияют на чувствительные пути на уровне зрительного бугра и коры головного мозга, еще предстоит выяснить.
Чрескожная электрическая стимуляция нерва (ЧЭСН). Электрическая стимуляция этим методом болезненного участка поверхности тела или проксимальнее расположенного нерва приводит к стойкому уменьшению боли у пациентов с травматическим повреждением нерва. Продолжительность эффекта, однако, обычно определяется длительностью стимуляции. У многих больных болеутоляющая реакция становится привычной через несколько дней или месяцев и электрическая стимуляция может на самом деле только усилить боль. .
Помощь при хронической боли. Непроходящая боль, которая приводит к потере трудоспособности в течение минимум 6 мес, обычно расценивается как хроническая боль. Пациенты с хронической болью часто требуют особого подхода при обследовании.
Когда больные с длительно существующей хронической болью обращаются к новому врачу, их ожидания часто преувеличены. Они обычно утверждают, что ни один из предыдущих врачей не был достаточно компетентным и что этот прием — их последняя надежда на избавление от страдания. Детальный анализ истории болезни часто позволяет сделать вывод, что больной плохо следовал рекомендациям, сделанным другими врачами.
Чтобы избежать очередной неудачи в лечении больного с хронической болью, следует привлечь к его обследованию многопрофильную группу специалистов, имеющих навыки в лечении хронического болевого синдрома. Состав этой группы может изменяться в зависимости от природы боли и от возможностей лечебного учреждения. Как минимум больной должен быть обследован терапевтом, психологом, невропатологом и физиотерапевтом. Такой подход устраняет возможную конфронтацию между больным и врачом, которая может уменьшить успех лечения, а также возрастает доверие ко всей группе, увеличивает веру больного в лечение. В ходе такого обследования следует наметить план лечения.
В целом необходимо остановиться на трех основных задачах. Во-первых, лечение лекарственными средствами необходимо упростить и свести к минимуму. У многих больных с хронической болью обычные болеутоляющие средства и миорелаксанты слабо эффективны. Поэтому пациенты самостоятельно увеличивают дозу в надежде получить облегчение. С согласия больного необходимо уменьшить число применяемых лекарственных средств, исключив лишние и неэффективные. Дозы оставшихся лекарственных средств необходимо затем постепенно уменьшить до величины, когда достигается выраженное благоприятное воздействие с минимальными побочными эффектами.
Во-вторых, задача лечения заключается в том, чтобы помочь больному наилучшим образом понять причину боли и факторы, которые приводят к ее обострению. Психологическое восприятие боли, ее взаимосвязь с развитием заболевания или с личностными особенностями отдельных больных не всегда легко оценить. Лечение антидепрессантами также играет роль в устранении эмоциональных симптомов у некоторых больных с хроническим болевым синдромом.
В-третьих, задача лечения должна заключаться в увеличении подвижности и функциональных возможностей. Специалисты в области реабилитационной медицины считают, что лечение боли физическими методами (ЧЭСН, массаж и т. д.) необходимо сочетать с физической тренировкой, чтобы увеличить подвижность в безболевом периоде. Необходимо составить реалистическую программу по возвращению навыков ухода за собой и способности к самостоятельному существованию.
Социальные и личностные факторы мешают устранению боли; некоторые больные с хроническим болевым синдромом поэтому не поддаются лечению в амбулаторных условиях. Госпитализация в стационар для многопрофильного лечения дает благоприятную возможность для выполнения интенсивного обследования и лечения таких больных. Стандарты для таких стационаров установлены Комитетом по стандартам Американского общества боли. Изучение опыта работы таких учреждений позволяет сделать вывод об увеличении эффективности организованного таким образом лечения: уменьшение потребления лекарственных средств и увеличение функциональной способности у большинства больных. Однако окончательный успех таких программ зависит от сохранения функционального улучшения у больных в течение длительного времени после выписки больного из лечебного учреждения. Для успешно справившихся с хронической болью пациентов, как и для других больных, обязательным становится тщательное диспансерное наблюдение и повторное обследование в стационаре.
Список литературы
Aronoff G. M. Psychological aspects of nonmalignant chronic pain. — In: Evaluation and Treatment of Chronic Pain/Ed. G. M. Aronoff. Baltimore: Urban and Schwarzenbe rg, 1985.
Asbury A., Field H. L. Pain due to peripheral nerve damage: a hypothesis. — Neurology, 1984, 34, 1587—1590.
Basbaum A. I., Fields //.. L. Endogenous pain control systems: brainstem spinal pathways and endorphin circuitry. — Ann. Rev. Neurosci., 1984, 7, 309—338.
Blumer D.. Heilbronn. Chronic pain as a variant of depressive disease. — J. Nerv. and Mental Dis., 1982, 170, 381—406.
Fields H. L. Pain II: new approaches to management. — Ann. Neurol., 1981, 9-, 101.
Hackett Т. P. The pain patient: evaluation and treatment. — In: Massachusetts General Hospital Handbook of General Hospital Psychiatrv/Ed. T. P. Hackett, 1978, 41—63.
Hannin gton-Kiff /. G. Antisympathetic drugs in limbs. — In: Textbook of Pain/Eds. P. D. Wall, R. Melzach. Edinburgh: Churchill Livingstone, 1983.
Maclewicz R., Fields H. L. Pain pathways. — In: Diseases of the Nervous System/Eds. A. Asbury, G. McKann. London: Saunders, 1986.
Sweet W. H., Poletti C. E. Causalgia. — In: Evaluation and Treatment of Chronic Pain/Ed. G. M. Aronoff. Baltimore: Urban and Schwarzenberg, 1985.
Tasker R. R. Deafferentation.— In: Textbook of Pain/Ed. P. Wall, Edinburgh, Churchill Livingstone, 1984, 119—132.
Taub A., Collins W. F. Observations on the treatment of de nervation dysesthesia with psychotropic drugs: postherpetic neuralgia, anesthesis dolorosa, peripheral neuropathy. — In: Adv. Neurol./Ed. J. J. Bonica. New York: Raven, 1974, 309—315. White J. C., Sweet W. H. Pain and Neurosurgeon — A Forty Year s Experience.
Springfield, Illinois, Charles C. Thomas, 1969.
Yaksh T. L., Hammond D. L. Peripheral and central substrates involved in the rostrad transmission of nociceptive information. Pain, 1982, 13, 1—85.
Дата добавления: 2015-07-22; просмотров: 1105;
