ЛЕКЦИЯ 13
Белки
Это биополимеры, состоящие из ста и более АК остатков.
Классификация: простые белки (протеины), состоящие из a-АК, сложные белки (протеиды), состоящие из белковой и небелковой частей.
Аминокислотный состав определяет многие св-ва белков: заряд белковой молекулы, ИЭТ, способность к осаждению, структуру и биологическую активность.
В настоящее время синтезированы простейшие белки – инсулин, рибонуклеаза, окситацин и др.
Первичная структура
При всем многообразии пептидов и белков принцип построения их молекул одинаков – связь между a-АК осуществляется за счет –СООН гр. одной АК и –NH2 гр. другой АК, которая в свою очередь своей карбоксильной группой связывается с аминогруппой третьей АК и т.д. Связь между остатками АК, а именно между группой С=О одной к-ты и группой NH другой к-ты, является амидной связью. В химии пептидов и белков она наз-ся пептидной связью:





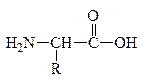




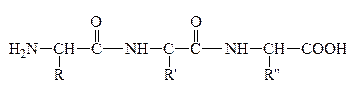
Пептидная связь
N-конец С-конец
Формально белковая или пептидная цепь представляет собой продукты поликонденсации АК. Один из концов цепи, где находится остаток АК со свободной аминогруппой, наз-ся N-концом (а сама АК – N–концевой), а другой конец цепи с остатком АК, имеющим свободную карбоксильную группу, наз-ся С–концом (а к-та - С-концевой). Т.о., пептидная цепь построена из повторяющихся скелет молекулы, и отдельных боковых групп – радикалов R, R/,R//.
Первичная структура пептидов и белков – это последовательность аминокислотных остатков в полипептидной цепи.
Сведения о последовательности a-АК остатков в цепи могут быть получены в результате постепенного, шаг за шагом, отщепления АК с одного конца цепи последующей идентификацией отщепленной a-АК. Такие методы существуют, и с их помощью установлена первичная структура многих пептидов и белков.
Для синтеза белка важен не только набор АК, но и порядок их соединения, т.е. первичная структура. Последняя обусловливает активность белков. Определенную последовательность АК в цепи дает использование операции “защита”.
1. “Защита” –NH2 гр. проводится методом ацилирования АК хлорангидридом или ангидром к-ты или на практике карбобензоксихлоридом (бензиловым эфиром хлормуравьиной к-ты):
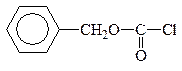
|
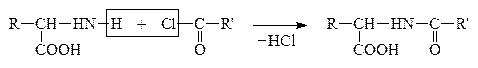
Ацилхлорид
2. “Защита” –СООН гр. проводится путем образования сложного эфира:
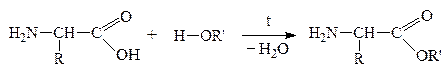
Затем проводят р-цию взаимодействия защищенных молекул в присутствии водоотнимающих средств. В этих условиях реагируют строго определенные группы –СООН первой молекулы и –NH2 – второй:

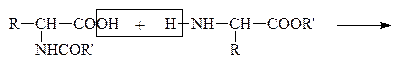
|
Затем проводят гидролиз в мягких условиях с освобождением защищенных групп и сохранением пептидной связи:
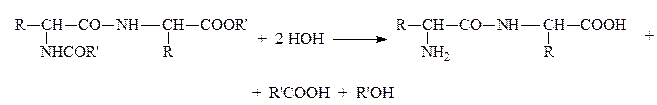
Стратегию пептидного синтеза разработал и осуществил Э.Фишер еще в начале ХХв. Последовательным наращиванием цепи из АК он синтезировал (1907) первое белковоподобное вещ-во, состоящее из 18 АК. Он показал, что АК являются “строительным материалом” белков. Он был автором гипотезы “ключа и замка”, объясняющей специфичность действия белковых катализаторов-ферментов.
Задача химического синтеза белковых макромолекул пока еще слишком сложна (и экономически неоправданна), но получение химическим путем относительно коротких пептидов в настоящее время вполне реально. Достижения в области синтеза пептидов позволяют автоматизировать процесс и вести его по заданной программе. С помощью приборов (синтезаторов) получены пептиды, содержащие десятки АК, и даже некоторые белки. Аналогично синтезу пептидов автоматизации поддается и метод анализа перичной структуры пептидов.
Вторичная структура
Цепи пептидов и белков принимают в пространстве определенную более или менее компактную форму. Уникальная особенность белковых молекул заключается в том, что они имеют, как правило, четкую пространственную структуру, или конформацию. В данном случае понятие конформации применяется для пространственного строения длинных полипептидных цепей. Как только молекула окажется развернутой или уложенной иным способом в пространстве она почти всегда теряет свою биологическую функцию.
Л.Полинг, Р.Кори (1951) на основании расчетов предсказали наиболее выгодные способы укладки цепей в пространстве.
Пептидная цепь может укладываться в виде спирали (подобно винтовой лестницы). В одном витке спирали помещается около четырех АК остатков. Закрепление спирали обеспечивается водородными связями между группами С=О и NН, направленными вдоль оси спирали. Все боковые радикалы R АК находятся снаружи спирали. Такая конформация наз-ся a-спиралью. Другой вариант упорядоченной структуры полипептидной цепи – b-структура, или b-складчатый слой. В этом случае скелет находится в зигзагообразной конформации, и цепи располагаются параллельно друг другу, удерживаясь Н-связями.
Вторичная структура белка – это более высокий уровень структурной организации, в котором закрепление конформации происходит за счет Н-связей между пептидными группами.
Конформация белковой молекулы стабилизируется не только Н-связями, но и за счет некоторых ионных взаимодействий, а также за счет окисления SН-групп боковых радикалов R возникает ковалентная дисульфидная связь.
Третичная структура
Это укладка полипептидной цепи, включающей элементы той или иной вторичной структуры в пространстве, т.е. образование трехмерной конфигурации белка.
Чаще всего это – клубок. Стабилизируют третичную структуру Н-связи, электростатическое взаимодействие заряженных групп, межмолекулярные силы Ван дер Ваальса, гидрофобные взаимодействия – вызванные вталкиванием радикалов R внутрь молекулы белка молекулами воды:



|
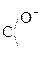
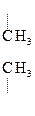
Электрическое Ковалентные Гидрофобное
 взаимодействие связи взаимодействие
взаимодействие связи взаимодействие
Дата добавления: 2015-07-22; просмотров: 720;
