Нервная трубка - первоисточник провизорных стволовых клеток
Подобно другим провизорным органам, нервная трубка является временным вместилищем стволовых клеток ЦНС. Нервная система зародыша человека возникает из трех областей нейроэктодермы: 1) нервной пластинки (ЦНС, соматические мотонейроны и преганглионарная часть вегетативной нервной системы) 2) клеток нервного гребня ( периферическая автономная нервная система) 3) эктодермальной плакоды (сенсорные ганглии краниальных нервов, гипофиз, нейроэпителий внутреннего уха и глаза). Процесс закладки и формирования нервной трубки протекает в несколько стадий. Сперва по краям нервной пластинки появляются мигрирующие нервные складки, которые, сливаясь по срединной линии, дают нервную трубку. Белковый продукт гомеозисного Sox-1 гена выявлялся в первичной нейроэктодерме, хотя мРНК всего семейства HMG-(high mobility group) Х-хромосомы гораздо раньше накапливались в зрелых яйцеклетках и сохранялись в ранних зародышах. Белки-репрессоры Sox-генов контролируют плотную упаковку хроматина с удержанием плюрипотентности генома клеток нейроэктодермы (Vriz S., Joly C., Boulekbache H. et al., 1999 ). Sox-1, Sox-2, Sox-3 гены уже экспрессированы в нейроэктодерме на стадиях образования первых сомитов Второй парой генов, контролирующих плюрипотентность генома нейроэктодермы, являются Xdbx и Xash3. Избыточная экспрессия этой пары генов в нервной трубке вызывала остановку созревания и избыточную пролиферацию незрелых клеток. Продукты последних двух генов блокировали эктопический нейрогенез НСК после пересадки кусочков нейроэктодермы в мозг реципиентов (Gershon A.A., Ridnick J., Kalam L. et al., 2000). Семейство Zic- генов также экспрессировано в начале нейрогенеза. В дорзальной части нервной трубки экспрессированы мРНК Zic-1 гена. После закрытия нервной трубки Zic-1 ген экспрессирован в клетках нервного гребня, включая мигрирующие прогениторные популяции, покидающие гребень.
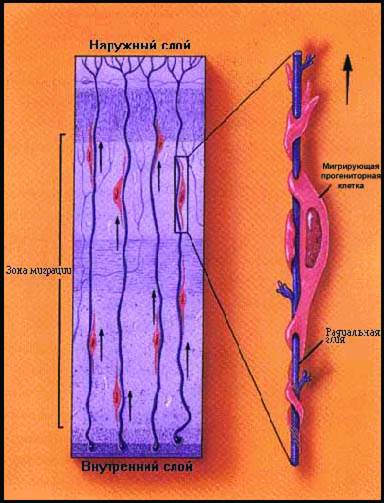
Рис 2-1. Схема направленной миграции прогениторных клеток мозга эмбрионов по матриксу радиальной глии
Рецепторы клеточной адгезии играли решающую роль в направленной миграции клеток нервной трубки. Передняя часть нервной трубки трансформировалась в головной мозг. Нервная трубка над нотохордой превращалась в спинной мозг. Первый прорыв был связан с расшифровкой механизма действия организатора, описанного в 20-х годах ХХ века Шпеманном и Мангольдом. Трансплантация нотохорды перепела в эмбрион цыпленка вызывала образование дополнительной нервной трубки. Это подтвердило эквипотенциальность организатора у разных видов. Эктопический гомотрансплантат клеток с сильно экспрессированным геном goosecoid индуцировал образование второй оси развития зародыша, причем донорские клетки "навязывали" зародышу-реципиенту экстра- нейруляцию. Опыты доказали ключевую роль гена goosecoid в запуске нейруляции (Boncinelli E., Mallamaci A., 1995). На следующем этапе транскриптаза goosecoid запускала второй эшелон регуляторов. Секретируемые окружающей тканью белки noggin, chordin, follistatin, Xnr3 инактивировали действие ВМР-7/ВМР-4, блокируя превращение плюрипотентной незрелой эктодермы в мезодерму. Стимуляторы нейруляции ( FGF -2, FGF-5, Wnt1, Wnt3, Sonic Hedgehog - SHH-A) направляли созревание плюрипотентных клеток в линии нейронов/глии. Мутация SHH-/- блокировала сегментацию и образование прозомеров в передней части нервной трубки мышей. Избыточная экспрессия транскриптазы Wnt-1 вела к региональной экспансии незрелых клеточных масс.
Баланс концентрации противоположных по эффекту сигналов направлял созревание нейроэпителия. Главным "вентральным" сигналом был белок SHH, секретируемый нотохордой. (Рис 2-2). Зародыши Mash-1 -/- мышей погибали из-за тотального блока развития нервной трубки, нарушения созревания гранулярных клеток мозжечка, рецепторных клеток внутреннего уха, краниальных сенсорных нейронов, обонятельных нейронов, адренэргических нейронов базальных структур мозга и периферической нервной системы. У Math1-/- мышей было блокировано развитие гранулярных нейронов мозжечка и рецепторных нейронов внутреннего уха. Этот же ген, видимо, выключал созревание гранулярных клеток мозжечка и рецепторных клеток вестибулярного аппарата и внутреннего уха (Helms A.W., Abney A.L., Ben-Arie N. et al., 2000).
  Стимуляторы пролиферации
SHH
Chordin
Noggin
Follistetin
Xnr3
FGF-2
FGF-5
Wnt-1
Wnt-3 Стимуляторы пролиферации
SHH
Chordin
Noggin
Follistetin
Xnr3
FGF-2
FGF-5
Wnt-1
Wnt-3
| 
| Блокаторы пролиферации BMP4 BMP7 дорзалин TGF-b Абортивный ранний нейрогенез |
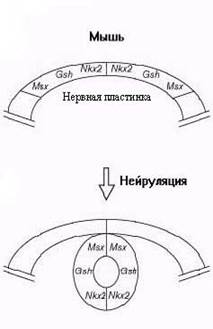
Рис 2-2. Схема экспрессии генов нейруляции
На больших растояниях эффект SHH уравновешивался Gli3- транскриптазой. С дорзальной стороны эпидермис генерировал три сигнала - ВМР-4, ВМР-7 и дорзалин (дериват TGF-beta). Латеральная экспрессия Рах-3 и Рах-6 в мезодерме необходима для нормального развития нервной трубки. Рах-3/Рах-6 метят прогениторные пролиферирующие клетки. Замыкание нервной трубки завершало образование монослоя нейроэпителия - эпендимы. У зародышей мышей Lim1-/- блокировано закрытие нервной трубки. Noggin, chordin, follistatin служили костимуляторами формирования нервной трубки. SHH множественными путями участвовал в нейруляции с разными группами плюрипотентных клеток. В ранних провизорных и стволовых клетках была выявлена изоформа SHH-A, которая напрямую связана с митотическим каскадом МАРК и с рецептором тирозиновой киназы RPTK ( Conti L., Sipione S., Magrassi L. et al , 2001). В новорожденном мозге SHC-A локализован исключительно в герментативном слое ЦНС. В постмитотических нейронах идентифицирована другая изоформа –SHC-C. Активаторы цАМФ и протеинкиназы С также стимулировали образование нервной трубки. Первичная нейруляция сопровождалась образованием нервного гребня из клеток нейромезенхимы .
В эпендиме/субэпендиме концентрировались главные пулы стволовых клеток нервной трубки, что верифицировано прокраской срезов развивающегося мозга мышей и крыс антителами к нестину. Количество нестин+ клеток (дериватов нейроэпителия трубки) экспоненциально нарастало по всем областям растущего мозга. Антитела к нестину окрашивали новообразованные клетки радиальной глии (РГ). Рост нестин+ клеточной массы визуально прослеживали на макросрезах головного мозга у трансгенных животных .
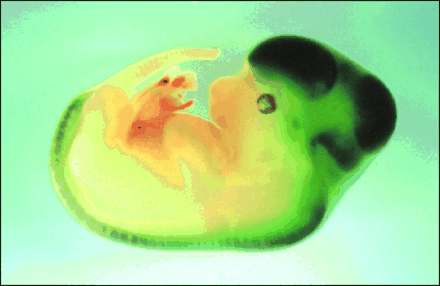
Рис 2-3. Визуализация нестин+ стволовых/прогениторных клеток в головном и спинном мозге зародыша мыши 16 дня развития
У трансгенных зародышей c вставленной конструкцией флуоресцентного GFP-белка под нестиновым промотером подавляющая часть светящихся клеток собрана вокруг перивентрикулярной области мозга. Слои GFP-окрашенных клеток радиально разрастались in situ, заполняя все быстро растущие области головного мозга. Зоны интенсивного роста состояли из клонов НСК, клетки которых делились и направленно мигрировали в новые отделы и ядра мозга. ( Рис. 2-3). На поздних стадиях созревания нейробластов градиент SHH достаточен для вентральной дифференцировки мотонейронов. С дорзальной стороны ВМР-4, ВМР-7 и дорзалин направляли дифференцировку сенсорных нейронов. В постнатальном периоде НСК сохранялись в эпендиме и субэпендимальном слое вокруг желудочков, а также в гиппокампе, обонятельной луковице, коре и других структурах (Dalstrand J., Lardelli M., Lendahl U.,1995).
Перивентрикулярная область взрослого мозга млекопитающих остается "реликтом" эмбрионального мозга с остатками стволовых ниш. В этих зонах сохранились гетерогенные популяции плюрипотентных клеток (Doetsch, F., Caille, I., Lim, D.A., et al., 1999). Эти клетки in situ прокрашивались антителами к нестину, виментину, GFAP и Noggin. Локальные инъекции Noggin стимулировали разрастание перивентрикулярных клонов прогениторных клеток в мозге взрослых животных (Lim D.A., Tramontin A.D.,Trevejo J.M. et al., 2000). Локальные инъекции bFGF, EGF стимулировали не только пролиферацию реципиентных, но и донорских НСК, трансплантированных в фетальный и постнатальный мозг млекопитающих (Abe K., Saito H., 2001; Fricker-Gates R.A., Winkler C., Kirik D. et al.,2000) Один из главных эффектов Noggin связан с нейтрализацией ВМР-4. В мозге взрослых животных локальные концентрации эндогенных стимуляторов пролиферации, по-видимому, уравновешивались высокой концентрацией ВМР-4 и ВМР-7. Эти условия тормозили обновление нервных клеток в перивентрикулярной области мозга взрослых. Практически в каждом послеоперационном образце субвентрикулярной ткани взрослых людей выявляли мелкие и крупные нейросферы, окруженные плотным матриксом и слоем астроглии, которая окрашивалась антителами на GFAP. Авторы предположили, что глия вокруг нейросфер играет роль фидера, формирующего стволовую нишу (Kukekov V.G., Laywell E.D., Suslov O. et al, 1999).
Вторым источником стволовых клеток является эпендима хориоидных плексусов. Ранее предполагали, что региональные сосудистые сплетения выполняет лишь трофическую функцию, секретируя в ликвор все необходимык ростовые и поддерживающие факторы. Питание стволовых перивентрикулярных пространств осуществляется через ликвор со стороны эпендимы (Leventhal C., Rafii S., Rafii D., et al, 1999). Сосудистые сплетения эмбрионального мозга имеют множественные зоны пролиферирующего эпителия, напоминающие по фенотипу стволовые клетки ( Коржевский Д.Е., 1999). У зародышей хориоидное сплетение играет роль поставщика нейральных стволовых клеток. Если нейроэпителий сплетения возникает из нервной трубки, то сосудистая мезенхима играет роль фидера, сохраняющего плюрипотентность НСК ( Kitada M., Chakrabortty S., Matsumoto N. et al.,2001). Эпендимальные клетки сосудистых сплетений были изолированы в культуру от так называемой «зеленой» трансгенной мыши, в которой ген флуоресцентного белка был поставлен под актиновый промотор. Практически это означало, что в культуре или после трансплантации клетки эпендимы светились флуоресцентной меткой. Исходные клетки эпендимы не прокрашивались антителами к виментину, нестину, GFAP, GLT-1, beta-tubulin III, MBP. После пересадки этих клеток в зону повреждения спинного мозга появлялись GFAP+, vimentin+ клетки, которые через 2-3 недели дифференцировались в типичные астроциты, но не нейроны. Часть НСК покидала сплетение и мигрировала в мозг ( Catala M., 1998). Однако выделить НСК в виде клонов in vitro из ткани хориоидных сплетений пока не удалось ( Gabrion J.B., Herbute S., Bouille C. et al., 1998)
Третьим источником НСК является «реликты» нейроэпителия, сохраняющегося в спинном мозге. Такие ранние нейроэпителиальные клетки при плотности 100-300 клеток/мл росли суспензионными клонами (нейросферами) на бактериальных чашках ( клоногенность = 1-2,5%) ( Kalyani A., Hobson K., Rao M.S., 1997). Клетки дезагрегированных нейросфер прикреплялись к дну чашек , покрытых ламинином, и дифференцировались в нейроны, глию и олигодендроциты. Нейросферы пассировали в селективной среде с bFGF и EGF. В отличие от НСК мозга ранние нейроэпителиальные клетки спинного мозга культивировали и размножали в прикрепленном недифференцированном состоянии в минимальных плотностях в среде с bFGF + экстракт зародыша цыпленка. Часть прикрепленных клеток окрашивалась антителами к нестину, 1-5 % клеток окрашивались антителами к GFAP. Часть клеток принадлежала к стволовым/прогениторным клеткам нервного гребня. Из этих предшественников дифференцировались шванновские клетки и периферические нейроны при добавлении цАМФ, сыворотки в среде, содержащей EGF,bFGF, NGF ( Kalyani A., Hobson K., Rao M.S., 1997). Пока не ясно, как обнаруженные особенности профиля НСК в спинном мозге связаны с особенностями эмбриогенеза. Нервная трубка спинного мозга детерминирована генерировать только сенсорные и моторные нейроны. На примере прогениторных клеток спинного мозга разработана иерархическая схема дерепрессии генов эмбриогенезов по сегментам спинного мозга. В исходных незрелых прогениторных клетках функционируют 5 комплексов репрессии генома. Последовательная дерепрессия открывает лишь один из 5 возможных способов активации хроматина. К примеру, SHH- зависимая активация гена Рах-6 открывает путь к дерепрессии только одного из 5 репрессоров второго эщелона –Nkx2.2/2.9. Первичная дерепрессия гена Irx вызывает селективную вторичную дерепрессию лишь Olig2. Селективная дерепрессия Dlbx2 вызывает комплементарную дерепрессию NKX6.1, а Dlbx1 активирует Nkx6.2. Такая сегментарно собранная сеть транскрипционных факторов позволяет в полуавтоматическом режиме обеспечивать сборку нервных сетей, собранных из мото – и сенсорных нейронов разного фенотипа. Исходно вся сеть собрана из общих ранних предшественников ( Lee S.K., Pfaff S.L.,2001).
Дата добавления: 2015-07-18; просмотров: 917;
