ЭСК: основные определения и концепция
Все специализированные клетки взрослого организма происходят из стволовых клеток. Стволовые клетки – это «запасники», «НЗ» информации развития (эмбриогенеза). Эту информацию развития нельзя свести с генам, поскольку каждый этап развития не запрограммирован автоматически, а связан с утилизацией сигналов и эпигенетической информации. ЭСК – это программа и процессор информации одновременно. Программы развития сильно меняются в зависимости от окружающей среды. Своевременное обновление репертура здоровых клеток является незаменимым условием здоровья и долголетия многоклеточного организма. Все органы взрослого человека и млекопитающих сохраняют «реликты» зародышевой ткани в виде микровкраплений стволовых клеток. Стволовые клетки – орган срочной макрорепарации при массированном повреждении ткани. Одновременно стволовые клетки – это аппарат обновления, смены устаревших «больных» клеток, в том числе для защиты от преждевременного старения. ЭСК позволяют избавиться от больных клеток не с помощью лекарств, а путем своевременной смены клеток.
Главная идея молекулярной медицины – найти лекарство для излечения больных клеткок - выглядит привлекательной, но непрактичной. Если в больном органе блокировано самообновление клеток, то накапливается множество аномальных клеток разного фенотипа. В этом случае понадобилось бы миллион «волшебных пуль» для нормализации миллиона разных больных клеток. Часто функциональная паренхима органов замещается производными мезенхимы (фиброз, атеросклеротические бляшки, глиоз и т.д.). Только факторы своевременной регенерации паренхимы способны защитить органы от повсеместного разрастания соединительной ткани.
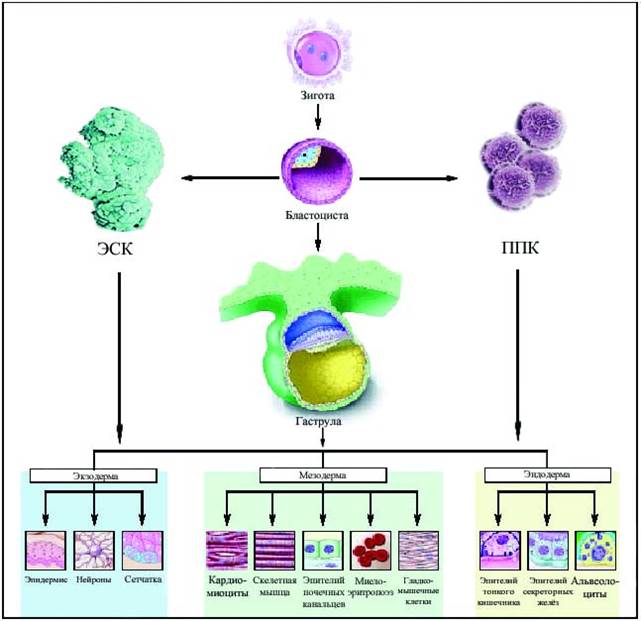
Рис 1-1 Лабораторные пути получения дериватов тканей человека из тотипотентных ЭСК и ППК
В геноме соматических клеток отсутствуют «программы» лечения. Геномика аномальных клеток использует несколько вариантов апоптоза для аутоэлиминации ненормальных клеток. С другой стороны пересадки СК ускоряют самообновление клеток в органах, в том числе элиминацию патологически измененных клеток.
Для исследователей ЭСК- это «шпаргалка» для расшифровки работы генома (особенно в период раннего эмбриогенеза и органогенеза). Необходимо напомнить, что изучение эмбриогенеза человека ограничено по биоэтическим соображениям. Постимплантационный эмбриогенез млекопитающих мышей, крыс, других лабораторных млекопитающих имеет существенные отличия. Во многих ситуациях ЭСК остаются единственной экспериментальной возможностью для моделирования событий, происходящих в зародыше человека после имплантации. Таким образом, ЭСК человека и млекопитающих – незаменимый путь для изучения аномалий постимплантационного развития зародышей. Самые ранние события кардиогенеза, миогенеза, нейрогенеза с дешифровкой soft-программ самосборки клеток в органы доступны пока лишь в культуре ЭСК (Kehat I., Kenyagin-Karsenti D., Snir M. Et al.,2001).
Для ЭСК характерно два варианта запрограммированного поведения в культуре. 1) незрелые ЭСК длительно размножаются в присутствии фидерного слоя клеток и ростовых факторов. 2) после наработки массы недифференцированных клеток, рамножение клеток останавливают, изменяя условия культивирования. Начинается дифференцировка клеток (желательно в один тип специализированных клеток) . (Рис 1-1)
ЭСК назвали "лабораторными лошадками" регенерации (Petit-Zeman, 2001), потому что регенерация органов практически невозможна за счет резерва собственных дифференцированных клеток. ЭСК «банкируются» in situ и повторяют фрагменты эмбриогенеза в тканях взрослого организма. Некоторые линии ЭСК человека удавалось пассировать без изменения фенотипа более 2 лет. Такие культуры прошли 300-450 циклов удвоения клеток без возникновения анеуплоидии или опухолей. При устранении фидера, ростовых факторов, а также после добавления сигналов начиналась медленная многоэтапная дифференцировка ЭСК в популяции дефинитивных, необратимо специализированных клеток. Интересно, что дифференцировка ЭСК в нейроны, кардиомиоциты идет за 10-15 дней, тогда как аналогичные процессы линейного созревания клеток в эмбрионе идут 5-7 нед (Kawasaki H., Suemori H., Mizuseki K. et al.,2002). В последнее время стали использовать сигналы фидерного слоя клеток для ускоренной дифференцировки клеток в культуре.
В зародыше и взрослом организме потенции генома стволовых клеток существенно варьируют по "ассортименту" фенотипа специализированных клеток. Более ранние, тотипотентные ЭСК дифференцируются в любую из 250 линий специализированных клеток органов. Необходимо подчеркнуть, что ЭСК in vitro не продуцируют клеток трофобласта, плаценты, т.е. потенции генома ЭСК меньше зиготы.. Соответственно биологический статус ЭСК меньше статуса раннего зародыша. Плюрипотентные ЭСК дают более ограниченный спектр фенотипов. Например, мезенхимальные стволовые клетки (МСК), локализованные в опорно-сосудистом каркасе органов, дифференцируются в культуре только в клетки хряща, кости, кардиомиоциты и миоциты. Монопотентные стволовые клетки (мышц, жировой ткани, периферических нервов) созревают до одного преобладающего фенотипа клеток. Стволовые региональные клетки взрослого организма наделены мультипотентностью-пластичной плюрипотентностью, которая сильно варьирует в контексте органа-реципиента. Так, пересадки гематогенных стволовых клеток в мозг, сердечную или скелетную мышцу приводили к образованию ткане-специфичных ростков донорской ткани в органах реципиента. Однократное переливание 0,5 л донорской женской крови мужчине-реципиенту химеризует женскими клетками все паренхиматозные органы (Korbling M., Katz R.L., Khanna A. et al., 2002). Большое внимание уделяется сейчас мультипотентным МСК взрослых органов, поскольку эти клетки хорошо мигрируют и многократно химеризуют ткани. В свою очередь, пересадки нейрональных стволовых клеток в печень, мышцу или иммунную систему сопровождались тканеспецифичной перестройкой фенотипа донорских клеток. Хорошо доказано, что сигналы микроокружения играют решающую роль в судьбе трансплантированных ЭСК/МСК in situ. Существенно, что ЭСК/МСК при дифференцировке в культуре давали лишь "природные" линии дифференцированных клеток, которые встречались в организме взрослого животного и человека. Никаких новых типов клеток или неизвестных линий дифференцированных клеток из ЭСК не возникало in vitro (O'Shea, 1999). Наблюдения подтверждены другими многочисленными работами, что снижает риск осложнений и повышает безопасность клеточной терапии дериватами стволовых клеток.
Тотипотентность ЭСК in situ проверяется несколькими способами. При трансплантации в морулу или бластоцисту донорские ЭСК встраиваются сначала в эпибласт и провизорные органы. Далее они мигрируют практически во все органы плода. После рождения ростки донорской ткани, дериватов ЭСК, выявляются и прогрессируют в костном мозге, кишечнике, коже, костях, печени, головном мозге, иммунной системе. Показано, что миграция ЭСК в ранних зародышах велика и практически не лимитирована до стадии сегментации. Пересадки ЭСК использовали для подсчета числа founder cells в закладках органов мыши, крысы, приматов. Усредненная эффективность химеризации линейно зависела от числа донорских клеток, заселивших эпибласт – главный орган образования founder cells. Идентичные пересадки МСК в морулу/бластоцисту овец и мышей приводили к накоплению и размножению донорских клеток только в костной, жировой, гематогенной, иммунной системе. МСК лишь ограничено накапливались в строме печени, легких, почек и мозга (Liechy KW, MacKenzie TC, Shaaban Af, 2000).Несовпадающее распределение МСК и ЭСК по тканям развивающихся эмбрионов является их важным отличительным маркером. Имплантация ЭСК и МСК в ранние зародыши никогда не заканчивалась малигнизацией. Показано, что ЭСК мыши (приматов) встраиваются в морулу, бластоцисту, эпибласт зародыша крысы. Закономерности встраивания МСК в эпибласт не изучены. Только часть территории эпибласта доступна для встраивания МСК. Поразительно, как клетки разных видов без помех взаимодействуют на уровне рецепторов, сигналов, программ, темпов развития химер. Химеры реализуют один трехмерный план строения без морфоаномалий (тератогенеза). У клеточных химер всегда доминирует морфотип беременной самки (O'Shea, 1999). Для скрининга тотипотентности in situ ЭСК пересаживали в разные органы иммунодефицитных мышей, либо изогенных животных (для исключения иммунного отторжения). Если пересадки предимплантационных зародышей в мозг всегда заканчивались резорбцией, то пересадки ЭСК в виде агрегатов (эмбриональных телец) давали стабильные ростки дифференцированной нервной ткани. На стадии эмбриоидных телец постмитотические клетки начинали дифференцироваться in vitro, необратимо теряя способность генерировать опухоли. Пролиферирующие незрелые ЭСК при пересадке в брюшную полость, под кожу или под капсулу почки давали опухоли (эмбриотератомы) у взрослых особей. Чем медленнее росла опухоль, тем больше была доля спонтанно дифференцированных клеток (Robertson, 1987; Watt, 2000). Эмбриотератомы содержали эпителий тонкого кишечника, миоциты, нейроны, кардиомиоциты, гладкомышечные клетки, фрагменты волос, кожи, хряща и кости. .
Поэтому линии ЭСК тщательно проверяются на канцерогенность в случае пересадок животным. Пересадки ЭСК в мозг никогда не сопровождались возникновением кардиомиоцитов, миоцитов или кожи. В свою очередь трансплантаты ЭСК в сердце не давали нейронов или секреторных клеток кишечника. Локальная дифференцировка ЭСК in situ, как правило, контролировалась "сигналами" микроокружения. Тотипотентность ЭСК человека проверяли по понятным причинам лишь на животных. Ограниченные клинические наблюдения также подтвердили отсутствие аномалий дифференцировки стволовых клеток в трансплантате.
Рост ЭСК в культуре идет клонами. В отличие от обычного экспоненциального размножения клеток в культуре, клон не растет, а самообновляется. Только в клоне сохраняется микроокружение, позволяющее стволовым клеткам удерживать необычно высокую генетическую потенцию. Эта особая геномика клеток сохраняется и воспроизводится только в плотной сфере. Каждая культура ЭСК имеет варьирующую долю клеток в суспензионных агрегатах (сферах). Одиночные клетки, покидая клон, неизбежно дифференцируются. Лишь агрегаты составляют суммарное пространство плюрипотентных клеток, остальные клетки специализируются под влиянием микроокружения. Большинство новых фенотипов возникает по периферии клонов. В каждом клоне клетки одновременно дифференцируются в разные фенотипы, подтверждая важность микроокружения (мозаика инструкций-сигналов может быть весьма разнообразной даже внутри одного клона).
Известно, что в первичной культуре эмбриобласта (эпибласта) обязательно сохраняют первичные агрегаты клеток при получении линий ЭСК (Talbot N.C., Carrett W.M., 2001) Одноклеточные суспензии эпибласта/эмбриобласта зародышей человека и обезьяны практически не выживали в первичной культуре. Внешние слои клона более активно пролиферировали в среде с ростовыми факторами (LIF, SCF, IL-6, bFGF, EGF,TGF-alpha). Состав и оптимальные концентрации факторов пролиферации подбираются эмпирически в каждой культуре. Более продвинутые клетки по периферии сфер гибли в селективной среде, предназначенной для выживания наименее зрелых популяций. Когда клеточные агрегаты достигали размера 30-50 клеток, наступало равновесие между пролиферацией и апоптозом. Каждый клон – это микромодуль самообновления клеток в постоянном миниобъеме. Репертуар прогениторных клеток постоянно меняется без изменения самого стволового пространства. Провизорные клоны сменяются дефинитивными клетками за счет множественных циклов самообновления клеток. Спонтанную дифференцировку и гибель клеток предотвращали повторным диспергированием агрегатов. Клоногенность – это способность культуры генерировать разную численность клон-инициирующих клеток на мл. Пока клоногенность существующих линий находилась на уровне 1-2 % (Pera M.F., 2001). Сигналы, запускающие инициацию клонов, практически не изучены. Выявлены варианты ЭСК, в которых исходно экспрессированы разные наборы генов, отвечающих за два главных качества клона: 1) плюрипотентность генома 2) самообновление прогениторных клеток (Morrison S.J., Shah N.M., Anderson D.J.,1997).
Даже малые концентрации сыворотки полностью блокировали клон-инициирующие клетки. В бессывороточной среде с помощью комбинации митогенов (bFGF, LIF) в лучшем случае удавалось поднять инициацию клонов в 3,5 раза. В каждом клоне присутствовали две популяции незрелых клеток с разным механизмом пролиферации. В ядре клона пролиферировали самообновляющиеся клетки с минимальным фенотипом и максимальной плюрипотентностью. На периферии клона некоммитированные прогениторные слои вступали в цикл созревания, который сопровождался усложнением белкового фенотипа и уменьшением генетической потентности клеток. Если в зародыше млекопитающих на стадии органогенеза половина клеток приходилась на провизорные некоммитированные клоны стволовых клеток, то в фетальной печени одна стволовая гематогенная клетка уже приходилась на 100000 гематогенных клеток. В кроветворной ткани взрослого человека насчитывается одна гематогенная стволовая клетка на 2-10 миллионов коммитированных клеток. Даже в короткоживущих организмах как дрозофила, многие клоны стволовых клеток в яичнике имеют среднюю продолжительность жизни около 20-25 дней (Morrison S., Shah N.M., Anderson D.,1997). Пока точно количественно не подсчитано, какое количество ЭСК выживает в разных органах человека и мыши после рождения.
Недавно получены линии мышиных ЭСК с эффективностью образования клонов порядка 20%. Их источником стали культуры ЭСК, меченые цветными белками, поставленными под промотор ранних генов (Rex-1), экспрессированных в ЭСК. Все светящиеся клетки отбирали на сортере, а линии получали из высокоочищенного сырья, поскольку продвинутые клетки всегда блокировали выживаемость и пролиферацию клон-инициирующих клеток. Эмпирически из очищенной популяции клеток удавалось получить культуры с 10-20% клоногенностью (Pera M.F., 2001). Существенно, что часть таких клонов стабильно сохраняла высокий индекс клеточной пролиферации.
Более продвинутые клетки не только конкурировали со стволовыми незрелыми клетками за лимитирующие факторы питания, но и секретировали в среду факторы, блокирующие плюрипотентность генома незрелых клеток. Культивирование стволовых клеток всегда начиналось с селективной среды, где 99% продвинутых клеток погибали, а малая часть выживших стволовых клеток начинала пролиферировать.

Рис 1-2. Основные характеристики ЭСК
· происхождение: клетки эпибласта, половые прогениторные клетки, перенос ядра донорской клетки в цитоплазму ооцита
· стабильная пролиферация без генетической модификации и онко-иммортализации
· клоногенный рост с самообновлением клеток
· плюрипотентность генома: источник всех фетальных и взрослых клеток кроме трофобласта и провизорных транзиторных клеток (нервный гребень и т.п.)
· рецептор – и GP-130- опосредованная супрессия дифференцировки плюрипотентных клеток
· Oct4 –опосредованное ингибирование транскрипции генома
· Отсутствие G1 –фазы митоза
· Отсутствие Х - инактивации в ХХ - клетках
· Колонизация всего зародыша, включая половой зачаток
· Видовые и тканевые различия в чувствительности ЭСК к митогенам и индукторам клеточной дифференцировки
Периферия клона использует "навигационную" информацию для направленного перемещения клеток. Пролиферация и миграция клеток отвечают за экспансию клонов и рост зародыша. Клон - эта повторяющийся модуль переноса и реализации software онтогенеза, в котором тотипотентность генома кодируется сначала наборами мРНК, а позднее - новым репертуаром белков.
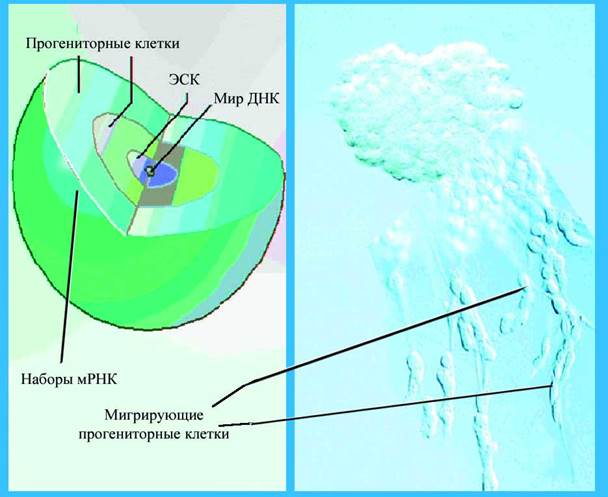
| Рис 1-3а Схематическое устройство клона ЭСК | Рис 1-3б Клон ЭСК с шлейфом мигрирующих клеток (фазово-контрастная микроскопия) |
В начале развития клон содержит прогениторные слои с одним набором мРНК. В конце развития тот же клон поставляет другие клетки с другим профилем мРНК. Простые клеточные деления вне клона потребовали бы огромного объема для реализации программ развития. Морула и бластоциста являются уникальной стволовой нишей, в которой пересаженные плюрипотентные клетки репрограммируются до потенции первых бластомеров. Предполагают, что это может быть связано с наличием уникальных белков репрограммирования – Id1,Id2, Id3 и Id4 (inhibitor of differentiation). Плюрипотентность эмбриобласта и тканей постимплантационныех зародышей обеспечивается разными комбинациями ID (Yen J., Manova K., Benezra R., 1997). Трофобласт, строма фидера для выращивания ЭСК, включая клетки Сертоли, также секретирует в среду наборы ID (Chaudhary J., Johnson J., Kim J. et al., 2001). Известно, гематогенные колонии из костного мозга взрослого человека синтезируют бета-цепь взрослого гемоглобина. Если взрослую региональную гематогенную клетку человека пересадить в бластоцисту мыши, то в химерном зародыше потомство донорских клеток начинают синтезировать сперва зародышевый, затем фетальный, позднее взрослый гемоглобин. Фенотип клеток четко идентифицируется разными генами вариабельной цепи гемоглобина. Поэтому пересадки стволовых гематогенных клеток взрослых пациентов в бластоцисту мыши (кролика) пытаются использовать для создания гуманизированных бластоцист мыши. Бластоцисты животных уже используют для репрограммирования генома и возвращения тотипотентности региональным стволовым клеткам человека. Бластоциста является природным миниинкубатором для репрограммирования ДНК более продвинутых клеток к нулевой точке развития. Аналогичным образом из гуманизированных химер в постимплантационном периоде можно рекапитулировать клетки первичной эктодермы, желточного мешка, сомитов и нервного гребня уже существовавшего человека.
Все сомиты зародыша мыши возникают примерно из 100-150 стволовых клеток эпибласта, занимающих строго фиксированную территорию (Dale K.J., Pourquie O., 2000). В клонах-предшественниках сомитов работают два гена-таймера (c-hairy1, lunatic fringe), которые обеспечивают ритмические, периодические волны пролиферации прогениторных клеток. Плюрипотентность пролиферирующих прогениторных клеток контролируется с помощью продукта гена Hes, а пролиферация клеток - за счет спаренного рецептора Delta-Notch. Далее в каждом сомите разворачивается индивидуальный профиль экспрессии генов во времени.
Сравнительный анализ показал, что линии ЭСК человека имеют существенные отличия от ЭСК животных по набору параметров: выживаемость и чувствительность к разным условиям культивирования, зависимость от митогенов и факторов апоптоза, факторов цитодифференцировки и сигналов, контролирующих функциональное созревание и поведение клеток in vitro (Carpenter M.K., Inokuma M.S., Denham J. et al., 2001). Поэтому данные, получаемые на ЭСК мышей, с большими оговорками экстраполируются на человека. Исследования генома плюрипотентных клеток животных, включая эффект лекарств, имеют сигнальное, но не решающее значение, особенно в областях прикладной медицины. Здесь нужны прямые эксперименты на ЭСК человека.
Существенно, что тотипотентность клона больше тотипотентности отдельных ЭСК (рис 1-2). Клон – это ансамбль тотипотентных ЭСК. Каждая ЭСК редактирует наборы мРНК по своим программам. Очевидно, что гетерогенный клон перерабатывает больше информации на языке мРНК, чем одна тотипотентная клетка... Основная часть мезенхимы (первоисточник соединительнотканного и сосудистого каркаса паренхиматозных органов) происходит из мезодермы. Ранее предполагали, что клоны паренхимы (функциональных повторяющихся единиц органа) и мезенхимы (опорная строма + коммуникации) возникают в зародыше независимо. Лишь недавно установлено, что практически все клоны провизорных некоммитированных клеток на стадии органогенеза представлены мозаикой тотипотентных провизорных клеток, имеющих ранние фенотипические маркеры трех зародышевых листков и мезенхимы. Любой такой клон представляет фрагмент тотипотентной ткани - той первичной "строительной глины", из которой "лепится" ранний зародыш. В лаборатории Герхарта налажено лабораторное получение экто-, мезо- и эндодермы из агрегатов (эмбриоидных телец) ЭСК, постоянно содержащих вкрапления мезенхимальных стволовых клеток. В зародыше мыши сначала количественно превалируют клоны провизорной экстраэмбриональной ткани. Как в культуре ЭСК, так и в ранних зародышах, появление экстраэмбриональной эндодермы маркируется экспрессией Hox-12 (Hox–4-7 гена) (Labosky P.A., Weir M.P., Grabel L.B.,1993). Только к середине беременности (10-11-й день) доля плюрипотентной ткани самого зародыша резко увеличивалось (Beddington R., Robertson E.J., 1999). До сих неизвестно, можно ли тотипотентность ЭСК довести до потенции генома зиготы. Если ЭСК пересадить в бластоцисту с удаленным эмбриобластом, развитие зародыша необратимо останавливается. В то же время пересадки ЭСК в 2-36-клеточный зародыш мыши ведут к внешне нормальному развитию химеры. Следовательно, потенциал ЭСК стыкуется с ранними бластомерами, но не стыкуется с клетками эмбриобласта/эпибласта. Это подтверждается невозможностью трансформации ЭСК в клетки эпибласта/эмбриобласта in vitro. (Smith A.G., 2001). Некоторые исследователи до сих пор считают иммортализованные линии ЭСК лабораторным артефактом – экспериментальным “трюком” обновления клонов, возникшим под влиянием эпигенетических сигналов. Поведение плюрипотентных клеток в культуре и зародыше существенно отличается. Ясно, что генетические потенции исходных стволовых зародышевых клеток больше, чем линий ЭСК. Даже в культуре под влиянием факторов микроокружения ЭСК способны генерировать множество фенотипов клеток. Гораздо хуже поняты возможности ЭСК в плане повторения событий эмбриогенеза in vitro.
Пересадки ЭСК в морулу, митозы в которой были остановлены цитокалазином, приводили к рождению зародышей, органы которых были собраны исключительно из донорских клеток. Неразвивающаяся морула играла важную роль пространственной матрицы, направляющей 3-D-взаимодействие ЭСК. Новый зародыш из донорских ЭСК развивается и на базе тетраплоидных бластомеров, которые прямо не участвуют в развитии.
Интенсивная миграция и колонизация донорскими ЭСК ранних зародышей не является каким-то эксклюзивным феноменом. Стволовые клетки взрослых тканей также имееют тенденцию к миграции и обмену. Пересадки сердца, печени, почек сыграли важную роль в изучении судьбы донорских стволовых клеток в организме реципиента. Оказалось, что после пересадки женских донорских органов мигрирующие стволовые клетки ХХ генотипа выявлялись практически во всех органах реципиента мужского пола через 10-12 месяцев после трансплантации. В количественном отношении посттрансплантационная химеризация сопоставима с химеризацией беременной матери клетками развивающегося эмбриона. В ряде случаев такое смешение гено/фенотипов сопровождалось частичной иммунотолератностью к антигенам донорских клеток (Uuaini F., Urbanek K., Beltrami A. et al.,2002)
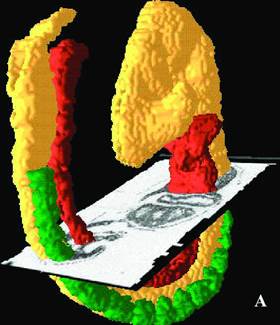
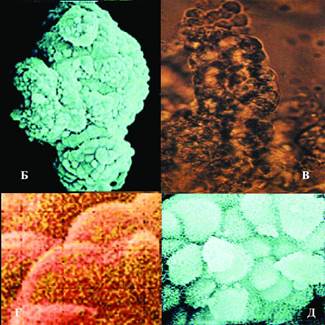
| Рис 1-4 Клональная организация тотипотентной ткани зародыша на стадии органогенеза | |
| А- компьютерная 3D-модель зародыша, Б- клон провизорных некоммитированных клеток под сканирующим электронным микроскопом | В- клон провизорных некоммитированных клеток Г,Д- межклеточные взаимодействия в клоне |
Почему клон провизорных мультипотентных ЭСК следует считать центральным звеном органогенеза? Клон передает информацию наборами мРНК. На периферии клона часть мРНК транслируется в изменение фенотипа клеток. На краю сферы появляются клетки с цитоскелетом, аппаратом локомоции для реализации "навигационной" информации. Подавляющее число клеток на периферии клонов направленно мигрируют, колонизуя новые пространства зародыше. Например, все структуры и центры головного мозга зародыша создаются за счет пришлых прогениторных клеток. Серийное размножение провизорных клонов зародыша необходимо для подготовки software органогенеза, которую невозможно уместить в нескольких клетках. В отличие от условий in vitro, в целом зародыше экспансия клонов контролируется генами сегментации и органогенеза (Нох-генами). Комбинации Нох-генов в клетках ретранслируются в трехмерную карту зародыша (включая численность клеток в будущих органах). Карта провизорных органов зародыша создается за счет прямых взаимодействий клонов трех зародышевых листков и мезенхимы. Организованный рост мезенхимы определяет организованный рост паренхимы каждого органа. В отличие от специализированных клеток ЭСК не являются полными автоматами. Сигналы микроокружения существенно влияли как на поведение, так и судьбу незрелых клеток. Факторы среды играли решающую роль в выборе пути рестрикционного созревания стволовых клеток как in vitro, так и in situ. Стволовые клетки мозга и полового зачатка характеризовались повышенной выживаемостью в переживающих фетальных тканях (клоны нейральных стволовых клеток удавалось выделить после 48-72 ч хранения ткани в холодильнике при +4С°). Поскольку парциальное содержание О2 в стволовых пространствах меньше чем в артериальной крови (2-3%), то измерение выживаемости ЭСК в стандартной газовой фазе культуры давали заниженные результаты. В ряде случаев выращивали СК при низком содержании кислорода в газовой фазе (Chakravarthy M.V., Spangenburg E.E., Booth F.W., 2001).
Первая плюрипотентная провизорная ткань зародыша мыши в количестве 600 клеток эпибласта появлялась на 6,5 дне беременности. Клетки эпибласта под влиянием экстраэмбриональной мезодермы подвергались эпителиомезенхимальной трансформации. Эти уникальные 600 клеток генерировали в течение нескольких циклов пролиферации коллекцию “founder cells” для всех закладок органов (Marshak D.R., Gottlieb D., Gardner R.L., 2001). Сегрегация герментативных клонов также происходила в эпибласте. К сожалению, клетки эпибласта невозможно идентифицировать по морфологическим деталям. Все клетки эпибласта маркировались поверхностным белком Crypto, содержащим домен EGF и участок, богатый цистеином (Beddington R., Robertson E.J., 1999). Зародыши мыши Crypto-/- останавливались в развитии на стадии эпибласта. Если максимальное число клеток в эмбриобласте мыши составляет порядка 350, то то в эпибласте численность клеток достигает 600. Поскольку клетки эпибласта интенсивно мигрируют и перемешиваются, это объясняет интенсивную химеризацию зародышей донорскими ЭСК, пересаженными в бластоцисту (Patrick P., Tam L., Gam G.M. et al., 2001). В эпибласте формируются главные центры клонального размножения и направленной миграции прогениторных клеток. Здесь начинается формирование зародышевых листков. Центральное событие гаструляции – это превращение двухмерной мозаики клеток эпибласта в трехмерный зародыш.
Пересадки нормальных ЭСК в зародыш Crypto-/- позволяли формировать химерную первичную полоску – вторую важнейшую провизорную плюрипотентную ткань. Этап формирования осей развития и миграции эпибласта маркировался экспрессией следующих генов: Hes-1, Lim-1, HNF3, Otx-2. Перечисленные гены необходимы для инициации сегментации зародыша. Любая нокаут мутация этих генов частично или полностью компенсировалась пересадкой нормальных ЭСК в эпибласт. Нескольких нормальных тотипотентных клеток в зародыше достаточно, чтобы пройти лимитирующую стадию органогенеза, где временно работает транскриптаза (типа Crypto). Ранние гены развития мозаично включаются лишь в части эпибласта, а не сразу во всех клетках. Это открывает новые способы внутриутробной клеточной реконструкции наследственных дефектов развития и тератогенеза. Надежная визуализация клеток эпибласта возможна только с помощью цветных белков, поставленных под промотер ранних генов (например, гена Crypto).
До сих пор не удалось превратить ЭСК в бластоцисту или клетки эпибласта. Получение лабораторного эпибласта из ЭСК – дело ближайшего будущего. Первые попытки получения эпибласта из ЭСК мышей в условиях культуры уже опубликованы (Rathjen J., Lake J.A., Betesse M.D. et al.,1999). ЭСК выращивали в среде ДМЕМ/Игл с 10% FCS без фидера, с добавлением LIF и кондиционированной среды после выращивания клеток гепатомы HEP-G2. Дифференцировка эмбриоидных агрегатов начиналась после удаления из среды LIF. В фазе пролиферации ЭСК экспрессировали типичные маркеры плбюрипотентных незрелых клеток – Oct4, щелочную фосфатазу, LIF, IL-6–рецептор, SSEA1- поверхностный антиген клеток. После остановки пролиферации дифференцировку контролировали по динамике экспрессии трех «ранних» генов. Созревание клеток эпибласта (первичной эктодермы) маркировали по нарастанию экспрессии мРНК гена FGF-5. Синхронно происходило снижение уровня мРНК генов Rex-1 и Gbx-2 до нулевого уровня в случае полной дифференцировки незрелых ЭСК в клетки эпибласта. Зрелые клетки эпибласта, возникшие in vitro, характеризовались утерей мРНК Oct4, Rex-1 и Gbx-2, но высоким уровнем мРНК FGF-5. Утрата Oct4 по времени совпадала с утерей способности новобразованных клеток эпибласта встраиваться в бластоцисту и химеризовать эмбриобласт ранних зародышей. Существенно, что образование клеток первичной эктодермы из ЭСК в культуре имело обратимый характер. При добавлении LIF и среды для выращивания ЭСК, фенотип клеток первичной эктодермы за две недели возвращался к фенотипу исходных плюрипотентных ЭСК мышей.(Rathjen J., Lake J.A., Bettesse M.D. et al., 1999).
ЭСК, полученные пересадкой ядер соматических клеток, проложили путь к
изучению переноса поведенческих навыков и элементарных физиологических программ у реципиента. С помощью пересадок ЭСК человека в сетчатку, гиппокамп, таламус, кору больших полушарий достигли ощутимой «гуманизизации» органов чувств и мозга животных с целью отследить эффект трансплантата на высшие функции ЦНС. Начало было положено передачей характерных навыков пения от перепела цыпленку с помощью пересадки кусочков нейроэктодермы (Long K.D., Kennedy G., Balaban E, 2001). Границы допустимых вмешательств в реконструктивной физиологии животных еще неотчетливо видны, поскольку не известен конечный результат таких действий.
Трансплантируя стволовые клетки, экспериментатор повторяет «слепые игры» эволюции с клетками мозга, приоткрывая пути участия стволовых клеток в сборке и сортировке сетей ЦНС. Если эволюция вслепую испытывает возможности ЭСК в сборке органов, то экспериментатор ищет идей и подтверждений того, каким образом стволовые клетки могут быть использованы в медицине для лечения заболеваний. Необходимо подчеркнуть, что эксперименты с пересадкой ЭСК человека всегда ограничены опытами на животных. Никакие знания на животных не могут служить полным обоснованием и достаточной платформой для апробации ЭСК на человеке. Только клиницист, а не экспериментатор определяет новые критерии и меру риска, позволяющие начать клинические испытания стволовых клеток как новый способ помощи больным людям, остающимся без лечения, с целью спасения или продления их жизни . Жестких правил и критериев, позволяющих транслировать знания предклинки в начало клинических испытаний, по-видимому не существует из-за сложности и невоспроизводимости многих ситуаций у постели больного, где начинает действовать многолетний опыт и экспертиза врача. Фундаментальные исследования ЭСК остаются лишь частью знаний, которые использует клиницист для принятия решений в новых ситуациях.
Дата добавления: 2015-07-18; просмотров: 978;
