Культивування органів
Органна культура – культивування in vitro органа або частини органа, у яких зберігаються анатомічний зв’язок і функціонування тканин, максимально наближених до таких в умовах in vivo, тобто в організмі. Міграція ізольованих клітин на периферії експланта придушується спеціальними умовами культивування, у результаті чого можуть навіть утворюватися диференційовані структури. Наприклад, на периферії експлантів легеневої тканини розвиваються нові дрібні бронхи, що складаються з альвеол, облямованих бронхіальним епітелієм.
Органна культура зберігає міжклітинні взаємодії, протягом довгого періоду підтримує гістологічну й гістохімічну диференціацію, як правило, залишається в не зростаючому стані протягом декількох днів і навіть тижнів. Ці культури не здатні до розмноження.
Тканини, залежні від гормонів, зберігають чутливість до них і характерні відповіді, ендокринні органи продовжують секрецію специфічних гормонів і т.д. Найбільша подібність процесів морфогенезу in vivo й in vitro відзначена для ембріональних тканин.
Перші дослідження в області культивування органів і тканин відносяться до кінця ХІХ століття. Уже в 1897 році німецький учений Льоб (В.Loeb) опублікував дані про культивування фрагментів печінки, нирок, щитовидної залози і яєчників кролика на невеликих кров’яних згустках у культуральних пробірках. Подальші дослідження показали, що для запобігання центральних некрозів в експлантах пробірки повинні бути заповнені киснем. У результаті численних експериментів було також встановлено, що більшість органів або їхніх фрагментів, за винятком шкіри, ростуть на твердому субстраті краще, ніж у рідкому середовищі.
Що ж можна використати як субстрат? Існує кілька видів техніки культивування органів. Як субстрат можна використати згусток плазми. Цей спосіб був запропонований Феллом і Робінсоном й одержав назву "техніка годинного скла", ставши класичною технікою морфогенетичного аналізу ембріональних органів (рис. 2).

Рис. 2. Метод годинних скелець (по Феллу й Робінсону, 1929)
Культивування проводять у западині годинного скла на поверхні згустку, що складається із плазми курчати й ембріонального екстракту курей. Годинникове скло поміщають у чашку Петрі й закривають зверху вологою ватою або фільтрувальним папером для запобігання висихання. Культивують у термостаті при 37,5ºС. Існують модифікації цього методу, при яких годинникове скло покривається кришкою, приклеєною воском та інші. Недоліком методу, що обмежує застосування його в біологічних дослідженнях, є розрідження згустку на краях експланта, що в результаті опиняється в рідині. Крім того, складний склад середовища ускладнює проведення біохімічних досліджень.
Ці недоліки усуваються при використанні згустку агару. Така техніка була запропонована Спраттом (рис. 3). Метод заснований на одержанні агарового гелю 1 – 4% концентрації, основу якого становлять забуферені сольові розчини або поживні середовища типу 199 з додаванням ембріональної сироватки.

Рис. 3. Метод годинних скелець з агаровим згустком (за Вольффом й Хафеном, 1952)
У середині 20-го століття Чен виявив, що культури можна вирощувати на паперових плотиках, що плавають на поверхні рідини в годинниковому склі. З метою поліпшення техніки пізніше папір обробляли силіконом, комбінували з міліпоровими фільтрами, а потім перейшли на плотики з ацетату віскози. Цей матеріал добре розчиняється в ацетоні, що полегшує підготовку тканини для гістологічного аналізу.
Метод культивування на плотиках не позбавлений недоліків, основний з них – занурення тканини в середовище при затопленні плотика. Рішення цієї проблеми було запропоновано Троувеллом, що запропонував культивувати органи на поверхні металевої сітки (рис. 4). Сітка являє собою квадрат розмірами 25×25 мм із відігнутими краями, що утворюють чотири ніжки висотою близько 4 мм. Скелетні тканини культивують безпосередньо на сітці, тоді як м’які спочатку експлантуються на папір, а потім поміщаються на сітку.
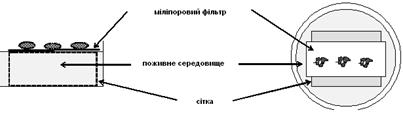
Рис. 4. Модифікований метод Троувелла (за І. Ласнітскі, 1989)
У 1976 році, для тривалого культивування дорослих тканин людини, таких як епітелій бронхів і молочної залози, стравоходу та ін. був запропонований метод почергового культивування в рідкому середовищі й газовій фазі. Для цього експланти прикріплюються до дна пластикової судини й покриваються середовищем. Судини поміщають у камеру з певним газовим складом, а камера встановлюється на хитку платформу.
Дата добавления: 2015-07-14; просмотров: 859;
