Наиболее загрязненных городов бывшего СССР.
Металлы приведены в порядке убывания уровня приоритетности для данного города.
| 1. Рудная Пристань (Приморский край) | свинец, цинк, медь, марганец+ванадий, марганец. |
| 2. Белово (Кемеровская область) | цинк, свинец, медь, никель. |
| 3. Ревда (Свердловская область) | медь, цинк, свинец. |
| 4. Магнитогорск | никель, цинк, свинец. |
| 5. Глубокое (Белоруссия) | медь, свинец, цинк. |
| 6. Усть-Каменогорск (Казахстан) | цинк, медь, никель. |
| 7. Дальнегорск (Приморский край) | свинец, цинк. |
| 8. Мончегорск (Мурманская область) | никель. |
| 9. Алаверди (Армения) | медь, никель, свинец. |
| 10. Константиновка (Украина, Донецкая обл) | свинец, ртуть. |
Ванадий
Ванадий находится преимущественно в рассеянном состоянии и обнаруживается в железных рудах, нефтях, асфальтах, битумах, горючих сланцах, углях и др. Одним из главных источников загрязнения природных вод ванадием являются нефть и продукты ее переработки.
В природных водах встречается в очень малой концентрации: в воде рек 0.2 - 4.5 мкг/дм3, в морской воде - в среднем 2 мкг/дм3
.
В воде образует устойчивые анионные комплексы (V4O12)4- и (V10O26)6-. В миграции ванадия существенна роль растворенных комплексных соединений его с органическими веществами, особенно с гумусовыми кислотами.
Повышенные концентрации ванадия вредны для здоровья человека. ПДКв ванадия составляет 0.1 мг/дм3 (лимитирующий показатель вредности — санитарно-токсикологический), ПДКвр - 0.001 мг/дм3.
Висмут
Естественными источниками поступления висмута в природные воды являются процессы выщелачивания висмутсодержащих минералов. Источником поступления в природные воды могут быть также сточные воды фармацевтических и парфюмерных производств, некоторых предприятий стекольной промышленности.
В незагрязненных поверхностных водах содержится в субмикрограммовых концентрациях. Наиболее высокая концентрация обнаружена в подземных водах и составляет 20 мкг/дм3, в морских водах - 0.02 мкг/дм3.ПДКв составляет 0.1 мг/дм3
Железо
Главными источниками соединений железа в поверхностных водах являются процессы химического выветривания горных пород, сопровождающиеся их механическим разрушением и растворением. В процессе взаимодействия с содержащимися в природных водах минеральными и органическими веществами образуется сложный комплекс соединений железа, находящихся в воде в растворенном, коллоидном и взвешенном состоянии. Значительные количества железа поступают с подземным стоком и со сточными водами предприятий металлургической, металлообрабатывающей, текстильной, лакокрасочной промышленности и с сельскохозяйственными стоками.
Фазовые равновесия зависят от химического состава вод, рН, Eh и в некоторой степени от температуры. В рутинном анализе во взвешенную форму выделяют частицы с размером более 0.45 мк. Она представляет собой преимущественно железосодержащие минералы, гидрат оксида железа и соединения железа, сорбированные на взвесях. Истинно растворенную и коллоидную форму обычно рассматривают совместно. Растворенное железо представлено соединениями, находящимися в ионной форме, в виде гидроксокомплекса и комплексов с растворенными неорганическими и органическими веществами природных вод. В ионной форме мигрирует главным образом Fe(II), а Fe(III) в отсутствие комплексообразующих веществне может в значительных количествах находиться в растворенном состоянии.
Железо обнаруживается в основном в водах с низкими значениями Eh.
В результате химического и биохимического (при участии железобактерий) окисления Fe(II) переходит в Fe(III), который, гидролизуясь, выпадает в осадок в виде Fe(OH)3. Как для Fе(II), так и для Fe(III) характерна склонность к образованию гидроксокомплексов типа [Fe(OH)2]+, [Fe2(OH)2]4+, [Fe(OH)3]+, [Fe2(OH)3]3+, [Fe(OH)3]- и других, сосуществующих в растворе в разных концентрациях в зависимости от рН и в целом определяющих состояние системы железо-гидроксил. Основной формой нахождения Fe(III) в поверхностных водах являются комплексные соединения его с растворенными неорганическими и органическими соединениями, главным образом гумусовыми веществами. При рН = 8.0 основной формой является Fe(OH)3 .Коллоидная форма железа наименее изучена, она представляет собой гидрат оксида железа Fe(OH)3 и комплексы с органическими веществами.
Содержание железа в поверхностных водах суши составляет десятые доли миллиграмма, вблизи болот - единицы миллиграммов. Повышенное содержание железа наблюдается в болотных водах, в которых оно находится в виде комплексов с солями гуминовых кислот - гуматами. Наибольшие концентрации железа (до нескольких десятков и сотен миллиграммов в 1 дм3) наблюдаются в подземных водах с низкими значениями рН.
Являясь биологически активным элементом, железо в определенной степени влияет на интенсивность развития фитопланктона и качественный состав микрофлоры в водоеме.
Концентрация железа подвержена заметным сезонным колебаниям. Обычно в водоемах с высокой биологической продуктивностью в период летней и зимней стагнации заметно увеличение концентрации железа в придонных слоях воды. Осенне-весеннее перемешивание водных масс (гомотермия) сопровождается окислением Fe(II) в Fе(III) и выпадением последнего в виде Fe(OH)3.
Содержание железа в воде выше 1-2 мг Fe/л значительно ухудшает органолептические свойства, придавая ей неприятный вяжущий вкус, и делает воду малопригодной для использования в технических целях. ПДКв железа составляет 0.3 мг Fe/дм3 (лимитирующий показатель вредности — органолептический), ПДКвр для железа - 0.1 мг/дм3
Кадмий
В природные воды поступает при выщелачивании почв, полиметаллических и медных руд, в результате разложения водных организмов, способных его накапливать. Соединения кадмия выносятся в поверхностные воды со сточными водами свинцово-цинковых заводов, рудообогатительных фабрик, ряда химических предприятий (производство серной кислоты), гальванического производства, а также с шахтными водами. Понижение концентрации растворенных соединений кадмия происходит за счет процессов сорбции, выпадения в осадок гидроксида и карбоната кадмия и потребления их водными организмами.
Растворенные формы кадмия в природных водах представляют собой главным образом минеральные и органо-минеральные комплексы. Основной взвешенной формой кадмия являются его сорбированные соединения. Значительная часть кадмия может мигрировать в составе клеток гидробионтов.
В речных незагрязненных и слабозагрязненных водах кадмий содержится в субмикрограммовых концентрациях, в загрязненных и сточных водах концентрация кадмия может достигать десятков микрограммов в 1 дм3.
Соединения кадмия играют важную роль в процессе жизнедеятельности животных и человека. В повышенных концентрациях токсичен, особенно в сочетании с другими токсичными веществами.
ПДКв составляет 0.001 мг/дм3, ПДКвр — 0.0005 мг/дм3 (лимитирующий признак вредности — токсикологический).
Кобальт
В природные воды соединения кобальта попадают в результате процессов выщелачивания их из медноколчедановых и других руд, из почв при разложении организмов и растений, а также со сточными водами металлургических, металлообрабатывающих и химических заводов. Некоторые количества кобальта поступают из почв в результате разложения растительных и животных организмов.
Соединения кобальта в природных водах находятся в растворенном и взвешенном состоянии, количественное соотношение между которыми определяется химическим составом воды, температурой и значениями рН. Растворенные формы представлены в основном комплексными соединениями, в т.ч. с органическими веществами природных вод. Соединения двухвалентного кобальта наиболее характерны для поверхностных вод. В присутствии окислителей возможно существование в заметных концентрациях трехвалентного кобальта.
Кобальт относится к числу биологически активных элементов и всегда содержится в организме животных и в растениях. С недостаточным содержанием его в почвах связано недостаточное содержание кобальта в растениях, что способствует развитию малокровия у животных (таежно-лесная нечерноземная зона). Входя в состав витамина В12, кобальт весьма активно влияет на поступление азотистых веществ, увеличение содержания хлорофилла и аскорбиновой кислоты, активизирует биосинтез и повышает содержание белкового азота в растениях. Вместе с тем повышенные концентрации соединений кобальта являются токсичными.
В речных незагрязненных и слабозагрязненных водах его содержание колеблется от десятых до тысячных долей миллиграмма в 1 дм3, среднее содержание в морской воде 0.5 мкг/дм3. ПДКв составляет 0.1 мг/дм3, ПДКвр 0.01 мг/дм3.
Марганец
В поверхностные воды марганец поступает в результате выщелачивания железомарганцевых руд и других минералов, содержащих марганец (пиролюзит, псиломелан, браунит, манганит, черная охра). Значительные количества марганца поступают в процессе разложения водных животных и растительных организмов, особенно сине-зеленых, диатомовых водорослей и высших водных растений. Соединения марганца выносятся в водоемы со сточными водами марганцевых обогатительных фабрик, металлургических заводов, предприятий химической промышленности и с шахтными водами.
Понижение концентрации ионов марганца в природных водах происходит в результате окисления Mn(II) до MnO2 и других высоковалентных оксидов, выпадающих в осадок. Основные параметры, определяющие реакцию окисления, - концентрация растворенного кислорода, величина рН и температура. Концентрация растворенных соединений марганца понижается вследствие утилизации их водорослями.
Главная форма миграции соединений марганца в поверхностных водах - взвеси, состав которых определяется в свою очередь составом пород, дренируемых водами, а также коллоидные гидроксиды тяжелых металлов и сорбированные соединения марганца. Существенное значение в миграции марганца в растворенной и коллоидной формах имеют органические вещества и процессы комплексообразования марганца с неорганическими и органическими лигандами. Mn(II) образует растворимые комплексы с бикарбонатами и сульфатами. Комплексы марганца с ионом хлора встречаются редко. Комплексные соединения Mn(II) с органическими веществами обычно менее прочны, чем с другими переходными металлами. К ним относятся соединения с аминами, органическими кислотами, аминокислотами и гумусовыми веществами. Mn(III) в повышенных концентрациях может находиться в растворенном состоянии только в присутствиии сильных комплексообразователей, Mn(YII) в природных водах не встречается.
В речных водах содержание марганца колеблется обычно от 1 до 160 мкг/дм3, среднее содержание в морских водах составляет 2 мкг/дм3, в подземных - n.102 - n.103 мкг/дм3.
Концентрация марганца в поверхностных водах подвержена сезонным колебаниям.
Факторами, определяющими изменения концентраций марганца, являются соотношение между поверхностным и подземным стоком, интенсивность потребления его при фотосинтезе, разложение фитопланктона, микроорганизмов и высшей водной растительности, а также процессы осаждения его на дно водных объектов.
Роль марганца в жизни высших растений и водорослей водоемов весьма велика. Марганец способствует утилизации CO2 растениями, чем повышает интенсивность фотосинтеза, участвует в процессах восстановления нитратов и ассимиляции азота растениями. Марганец способствует переходу активного Fe(II) в Fe(III), что предохраняет клетку от отравления, ускоряет рост организмов и т.д. Важная экологическая и физиологическая роль марганца вызывает необходимость изучения и распределения марганца в природных водах.
Для водоемов санитарно-бытового использования установлена ПДКв (по иону марганца), равная 0.1 мг/дм3.
Ниже представлены карты распределения средних концентраций металлов: марганца, меди, никеля и свинца, построенные по данным наблюдений за 1989 - 1993 гг. в 123 городах. Использование более поздних данных предполагается нецелесообразным, поскольку в связи с сокращением производства значительно снизились концентрации взвешенных веществ и соответственно, металлов.
Влияние на здоровье. Многие металлы являются составляющей пыли и оказывают существенное влияние на здоровье.
Марганец поступает в атмосферу от выбросов предприятий черной металлургии (60% всех выбросов марганца), машиностроения и металлообработки (23%), цветной металлургии (9%), многочисленных мелких источников, например, от сварочных работ.
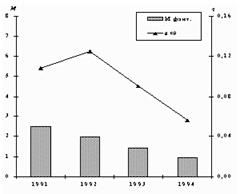 Высокие концентрации марганца приводят к появлению нейротоксических эффектов, прогрессирующего поражения центральной нервной системы, пневмонии.
Высокие концентрации марганца приводят к появлению нейротоксических эффектов, прогрессирующего поражения центральной нервной системы, пневмонии.
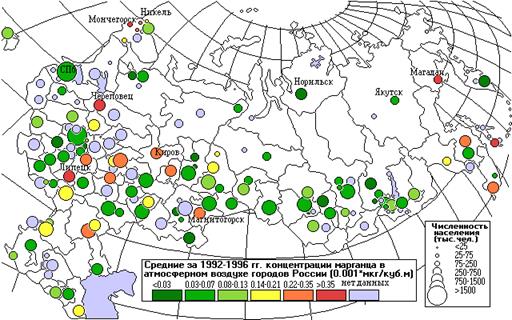
Самые высокие концентрации марганца (0,57 - 0,66 мкг/м3) наблюдаются в крупных центрах металлургии: Липецке и Череповце, а также в Магадане. Больше всего городов с высокими концентрациями Mn (0,23 - 0,69 мкг/м3) сосредоточено на Кольском полуострове: Заполярный, Кандалакша, Мончегорск, Оленегорск (см. карту).
За 1991 - 1994 гг. выбросы марганца от промышленных источников снизились на 62%, средние концентрации – на 48%.
 |
Медь
Медь - один из важнейших микроэлементов. Физиологическая активность меди связана главным образом с включением ее в состав активных центров окислительно-восстановительных ферментов. Недостаточное содержание меди в почвах отрицательно влияет на синтез белков, жиров и витаминов и способствует бесплодию растительных организмов. Медь участвует в процессе фотосинтеза и влияет на усвоение азота растениями. Вместе с тем, избыточные концентрации меди оказывают неблагоприятное воздействие на растительные и животные организмы.
Содержание меди в природных пресных водах колеблется от 2 до 30 мкг/дм3, в морских водах - от 0.5 до 3.5 мкг/дм3. Повышенные концентрации меди (до нескольких граммов в литре) характерны для кислых рудничных вод.
В природных водах наиболее часто встречаются соединения Cu(II). Из соединений Cu(I) наиболее распространены труднорастворимые в воде Cu2O, Cu2S, CuCl. При наличии в водной среде лигандов наряду с равновесием диссоциации гидроксида необходимо учитывать образование различных комплексных форм, находящихся в равновесии с акваионами металла.
Основным источником поступления меди в природные воды являются сточные воды предприятий химической, металлургической промышленности, шахтные воды, альдегидные реагенты, используемые для уничтожения водорослей. Медь может появляться в результате коррозии медных трубопроводов и других сооружений, используемых в системах водоснабжения. В подземных водах содержание меди обусловлено взаимодействием воды с горными породами, содержащими ее (халькопирит, халькозин, ковеллин, борнит, малахит, азурит, хризаколла, бротантин).
Предельно допустимая концентрация меди в воде водоемов санитарно-бытового водопользования составляет 0.1 мг/дм3 (лимитирующий признак вредности — общесанитарный), в воде рыбохозяйственных водоемов - 0.001 мг/дм3.
 Город Город
| M |
| Норильск | 2382,3 |
| Ревда | 1162,9 |
| Мончегорск | 933,7 |
| Красноуральск | 653,0 |
| Кольчугино | 140,1 |
| Никель | 81,8 |
| Заполярный | 81,0 |
Выбросы М (тыс.т/год) оксида меди и среднегодовые концентрации q (мкг/м3) меди.
Медь поступает в воздух с выбросами металлургических производств. В выбросах твердых веществ она содержится в основном в виде соединений, преимущественно оксида меди.
На долю предприятий цветной металлургии приходится 98,7 % всех антропогенных выбросов этого металла, из них 71% осуществляется предприятиями концерна “Норильский никель”, расположенными в Заполярном и Никеле, Мончегорске и Норильске, а еще примерно 25% выбросов меди осуществляются в Ревде, Красноуральске, Кольчугино и в других.
 Высокие концентрации меди приводят к интоксикации, анемии и заболеванию гепатитом.
Высокие концентрации меди приводят к интоксикации, анемии и заболеванию гепатитом.
Как видно из карты, самые высокие концентрации меди отмечены в городах Липецк и Рудная Пристань. Повышены также концентрации меди в городах Кольского полуострова, в Заполярном, Мончегорске, Никеле, Оленегорске, а также в Норильске.
Выбросы меди от промышленных источников снизились на 34%, средние концентрации – на 42%.
Молибден
Соединения молибдена попадают в поверхностные воды в результате выщелачивания их из экзогенных минералов, содержащих молибден. Молибден попадает в водоемы также со сточными водами обогатительных фабрик, предприятий цветной металлургии. Понижение концентраций соединений молибдена происходит в результате выпадения в осадок труднорастворимых соединений, процессов адсорбции минеральными взвесями и потребления растительными водными организмами.
Молибден в поверхностных водах находится в основном в форме МоО42-. Весьма вероятно существование его в виде органоминеральных комплексов. Возможность некоторого накопления в коллоидном состоянии вытекает из того факта, что продукты окисления молибденита представляют рыхлые тонкодисперсные вещества.
В речных водах молибден обнаружен в концентрациях от 2.1 до 10.6 мкг/дм3. В морской воде содержится в среднем 10 мкг/дм3 молибдена.
В малых количествах молибден необходим для нормального развития растительных и животных организмов. Молибден входит в состав фермента ксантиноксидазы. При дефиците молибдена фермент образуется в недостаточном количестве, что вызывает отрицательные реакции организма. В повышенных концентрациях молибден вреден. При избытке молибдена нарушается обмен веществ.
Предельно допустимая концентрация молибдена в водоемах санитарно-бытового использования составляет 0.25 мг/дм3.
Мышьяк
В природные воды мышьяк поступает из минеральных источников, районов мышьяковистого оруднения (мышьяковый колчедан, реальгар, аурипигмент), а также из зон окисления пород полиметаллического, медно-кобальтового и вольфрамового типов. Некоторое количество мышьяка поступает из почв, а также в результате разложения растительных и животных организмов. Потребление мышьяка водными организмами является одной из причин понижения концентрации его в воде, наиболее отчетливо проявляющегося в период интенсивного развития планктона.
Значительные количества мышьяка поступают в водные объекты со сточными водами обогатительных фабрик, отходами производства красителей, кожевенных заводов и предприятий, производящих пестициды, а также с сельскохозяйственных угодий, на которых применяются пестициды.
В природных водах соединения мышьяка находятся в растворенном и взвешенном состоянии, соотношение между которыми определяется химическим составом воды и значениями рН. В растворенной форме мышьяк встречается в трех- и пятивалентной форме, главным образом в виде анионов.
В речных незагрязненных водах мышьяк находится обычно в микрограммовых концентрациях. В минеральных водах его концентрация может достигать нескольких миллиграммов в 1 дм3, в морских водах в среднем содержится 3 мкг/дм3, в подземных - встречается в концентрациях n.105 мкг/дм3. Соединения мышьяка в повышенных концентрациях являются токсичными для организма животных и человека: они тормозят окислительные процессы, угнетают снабжение кислородом органов и тканей.
ПДКв мышьяка составляет 0.05 мг/дм3 (лимитирующий показатель вредности — санитарно-токсикологический) и ПДКвр - 0.05 мг/дм3.
Никель
Присутствие никеля в природных водах обусловлено составом пород, через которые проходит вода: он обнаруживается в местах месторождений сульфидных медно-никелевых руд и железо-никелевых руд. В воду попадает из почв и из растительных и животных организмов при их распаде. Повышенное по сравнению с другими типами водорослей содержание никеля обнаружено в сине-зеленых водорослях. Соединения никеля в водные объекты поступают также со сточными водами цехов никелирования, заводов синтетического каучука, никелевых обогатительных фабрик. Огромные выбросы никеля сопровождают сжигание ископаемого топлива.
Концентрация его может понижаться в результате выпадения в осадок таких соединений, как цианиды, сульфиды, карбонаты или гидроксиды (при повышении значений рН), за счет потребления его водными организмами и процессов адсорбции.
В поверхностных водах соединения никеля находятся в растворенном, взвешенном и коллоидном состоянии, количественное соотношение между которыми зависит от состава воды, температуры и значений рН. Сорбентами соединений никеля могут быть гидроксид железа, органические вещества, высокодисперсный карбонат кальция, глины. Растворенные формы представляют собой главным образом комплексные ионы, наиболее часто с аминокислотами, гуминовыми и фульвокислотами, а также в виде прочного цианидного комплекса. Наиболее распространены в природных водах соединения никеля, в которых он находится в степени окисления +2. Соединения Ni3+ образуются обычно в щелочной среде.
Соединения никеля играют важную роль в кроветворных процессах, являясь катализаторами. Повышенное его содержание оказывает специфическое действие на сердечно-сосудистую систему. Никель принадлежит к числу канцерогенных элементов. Он способен вызывать респираторные заболевания. Считается, что свободные ионы никеля (Ni2+) примерно в 2 раза более токсичны, чем его комплексные соединения.
 |
В речных незагрязненных и слабозагрязненных водах концентрация никеля колеблется обычно от 0.8 до 10 мкг/дм3; в загрязненных она составляет несколько десятков микрограммов в 1 дм3. Средняя концентрация никеля в морской воде 2 мкг/дм3, в подземных водах - n.103 мкг/дм3. В подземных водах, омывающих никельсодержащие горные породы, концентрация никеля иногда возрастает до 20 мг/дм3.
Содержание никеля в водных объектах лимитируется: ПДКв составляет 0.1 мг/дм3 (лимитирующий признак вредности — общесанитарный), ПДКвр — 0.01 мг/дм3 (лимитирующий признак вредности — токсикологический).
Никель поступает в атмосферу от предприятий цветной металлургии, на долю которых приходится 97% всех выбросов никеля, из них 89% на долю предприятий концерна “Норильский никель”, расположенных в Заполярном и Никеле, Мончегорске и Норильске.
 Повышенное содержание никеля в окружающей среде приводит к появлению эндемических заболеваний, бронхиального рака. Соединения никеля относят к 1 группе канцерогенов.
Повышенное содержание никеля в окружающей среде приводит к появлению эндемических заболеваний, бронхиального рака. Соединения никеля относят к 1 группе канцерогенов.
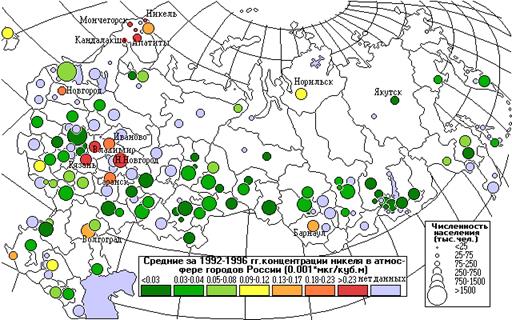
На карте видно несколько точек с высокими средними концентрациями никеля в местах расположения концерна Норильский никель: Апатиты, Кандалакша, Мончегорск, Оленегорск.
Выбросы никеля от промышленных предприятий снизились на 28%, средние концентрации – на 35%.
Выбросы М (тыс.т/год) и среднегодовые концентрации q (мкг/м3) никеля.
Олово
В природные воды поступает в результате процессов выщелачивания оловосодержащих минералов (касситерит, станнин), а также со сточными водами различных производств (крашение тканей, синтез органических красок, производство сплавов с добавкой олова и др.).
Токсическое действие олова невелико.
В незагрязненных поверхностных водах олово содержится в субмикрограммовых концентрациях. В подземных водах его концентрация достигает единиц микрограммов в 1 дм3. ПДКв составляет 2 мг/дм3.
Ртуть
В поверхностные воды соединения ртути могут поступать в результате выщелачивания пород в районе ртутных месторождений (киноварь, метациннабарит, ливингстонит), в процессе разложения водных организмов, накапливающих ртуть. Значительные количества поступают в водные объекты со сточными водами предприятий, производящих красители, пестициды, фармацевтические препараты, некоторые взрывчатые вещества. Тепловые электростанции, работающие на угле, выбрасывают в атмосферу значительные количества соединений ртути, которые в результате мокрых и сухих выпадений попадают в водные объекты.
Понижение концентрации растворенных соединений ртути происходит в результате извлечения их многими морскими и пресноводными организмами, обладающими способностью накапливать ее в концентрациях, во много раз превышающих содержание ее в воде, а также процессов адсорбции взвешенными веществами и донными отложениями.
В поверхностных водах соединения ртути находятся в растворенном и взвешенном состоянии. Соотношение между ними зависит от химического состава воды и значений рН. Взвешенная ртуть представляет собой сорбированые соединения ртути. Растворенными формами являются недиссоциированные молекулы, комплексные органические и минеральные соединения. В воде водных объектов ртуть может находиться в виде метилртутных соединений.
Содержание ртути в речных незагрязненных, слабозагрязненных водах составляет несколько десятых долей микрограмма в 1 дм3, средняя концентрация в морской воде 0.03 мкг/дм3, в подземных водах 1-3 мкг/дм3.
Соединения ртути высоко токсичны, они поражают нервную систему человека, вызывают изменения со стороны слизистой оболочки, нарушение двигательной функции и секреции желудочно-кишечного тракта, изменения в крови и др. Бактериальные процессы метилирования направлены на образование метилртутных соединений, которые во много раз токсичнее минеральных солей ртути. Метилртутные соединения накапливаются в рыбе и могут попадать в организм человека.
ПДКв ртути составляет 0.0005 мг/дм3 (лимитирующий признак вредности — санитарно-токсикологический), ПДКвр 0.0001 мг/дм3.
Свинец
Естественными источниками поступления свинца в поверхностные воды являются процессы растворения эндогенных (галенит) и экзогенных (англезит, церуссит и др.) минералов. Значительное повышение содержания свинца в окружающей среде (в т.ч. и в поверхностных водах) связано со сжиганием углей, применением тетраэтилсвинца в качестве антидетонатора в моторном топливе, с выносом в водные объекты со сточными водами рудообогатительных фабрик, некоторых металлургических заводов, химических производств, шахт и т.д. Существенными факторами понижения концентрации свинца в воде является адсорбция его взвешенными веществами и осаждение с ними в донные отложения. В числе других металлов свинец извлекается и накапливается гидробионтами.
Свинец находится в природных водах в растворенном и взвешенном (сорбированном) состоянии. В растворенной форме встречается в виде минеральных и органоминеральных комплексов, а также простых ионов, в нерастворимой - главным образом в виде сульфидов, сульфатов и карбонатов.
В речных водах концентрация свинца колеблется от десятых долей до единиц микрограммов в 1 дм3. Даже в воде водных объектов, прилегающих к районам полиметаллических руд, концентрация его редко достигает десятков миллиграммов в 1 дм3. Лишь в хлоридных термальных водах концентрация свинца иногда достигает нескольких миллиграммов в 1 дм3.
Лимитирующий показатель вредности свинца - санитарно-токсилогический. ПДКв свинца составляет 0.03 мг/дм3, ПДКвр - 0.1 мг/дм3.
Свинец содержится в выбросах предприятиями металлургии, металлообработки, электротехники, нефтехимии и автотранспорта.
Влияние свинца на здоровье происходит при вдыхании воздуха, содержащего свинец, и поступлении свинца с пищей, водой, на пылевых частицах. Свинец накапливается в теле, в костях и поверхностных тканях. Свинец влияет на почки, печень, нервную систему и органы кровообразования. Пожилые и дети особенно чувствительны даже к низким дозам свинца.
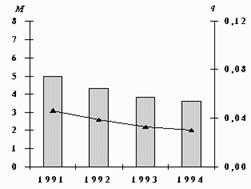
Выбросы М (тыс.т/год) и среднегодовые концентрации q (мкг/м3) свинца.
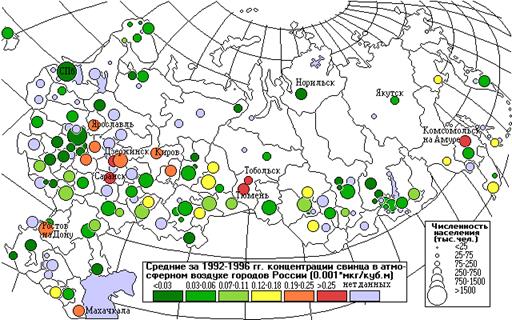 |
За семь лет выбросы свинца от промышленных источников снизились на 60% вследствие сокращения производства и закрытия многих предприятий. Резкое снижение промышленных выбросов не сопровождается снижением выбросов автотранспорта. Средние концентрации свинца снизились только на 41%. Различие в степени снижения выбросов и концентраций свинца можно объяснить неполным учетом выбросов от автомобилей в предыдущие годы; в настоящее время увеличилось количество автомобилей и интенсивность их движения.
Дата добавления: 2015-08-26; просмотров: 2723;
