Исследование агрегации тромбоцитов
Общее ориентировочное представление об агрегационной способности тромбоцитов можно составить с помощью качественных методов, основанных на визуальном определении тромбоцитарных агрегатов, образующихся в пробирке (макроскопический метод) или на предметном стекле (микроскопический метод по А.С.Шитиковой) при смешивании тромбоцитарной плазмы с различными, чаще естественными, стимуляторами агрегации. В качестве последних используют растворы АДФ, тромбина, адреналина, коллагена, ристомицина.
Регистрируют время образования крупных агрегатов тромбоцитов, которое в норме обычно не превышает 10–60 с.
Наиболее полная оценка агрегационной способности тромбоцитов осуществляется при количественной фотометрической или спектрофотометрической регистрации процесса агрегации с помощью агрегографов различной конструкции.
Методы заключаются в графической регистрации изменения оптической плотности тромбоцитарной плазмы при перемешивании ее со стимуляторами агрегации (рис. 1.91).

Рис. 1.91. Кривые агрегации тромбоцитов, индуцированной АДФ малой концентрации.
Образование тромбоцитарных агрегатов ведет к увеличению светопропускающей способности тромбоцитарной плазмы.
Полученные агрегатограммы анализируют по нескольким количественным параметрам: времени начала агрегации после добавления соответствующего стимулятора, амплитуде агрегатограммы на 2-й и 6-й минутах, общей площади агрегатограммы и др. В зависимости от используемого стимулятора и его дозы агрегатограмма может иметь различную форму. При использовании в качестве стимуляторов агрегации тромбоцитов коллагена, тромбина, ристомицина регистрируют одну большую волну агрегации, а при добавлении к тромбоцитарной плазме малых доз АДФ — двухволновую агрегатограмму (рис. 1.91, а).
На агрегатограммах, полученных при использовании в качестве стимулятора малых доз АДФ, первая волна регистрируемой кривой отражает начальную агрегацию тромбоцитов, обусловленную введением извне стимулятора этого процесса. Вторая волна связана с реакцией высвобождения из тромбоцитов собственных биологически активных веществ (адреналина, АДФ, тромбоксана А2 и др.), которые усиливают начавшуюся агрегацию кровяных пластинок.
Запомните  Отсутствие на агрегатограммах, полученных при использовании в качестве стимулятора малых доз АДФ, второй волны агрегации свидетельствует об уменьшении в тромбоцитах гранул, содержащих биологически активные вещества (недостаточность пула хранения), или о нарушении реакции высвобождения этих веществ из тромбоцитов.
Отсутствие на агрегатограммах, полученных при использовании в качестве стимулятора малых доз АДФ, второй волны агрегации свидетельствует об уменьшении в тромбоцитах гранул, содержащих биологически активные вещества (недостаточность пула хранения), или о нарушении реакции высвобождения этих веществ из тромбоцитов.
|
В приложении 2 712051129 представлены примеры нарушения функций тромбоцитов при наиболее частых формах врожденных и приобретенных тромбоцитопатий и тромбоцитопений. Современные методы сосудисто‑тромбоцитарного гомеостаза в большинстве случаев дает возможность дифференцировать подобные состояния, по крайней мере, если они протекают в классической типичной форме.
В приложении 3 712051133 приведены принципы диагностики нарушений сосудисто-тромбоцитарного гемостаза.
4. Коагуляционный[Мф12] гемостаз: теория А.А.Шмидта–П.Моравитца
Вторичный, или коагуляционный, гемостаз обеспечивает плотную закупорку поврежденных сосудов красным тромбом, состоящим из сети волокон фибрина с захваченными ею клетками крови (тромбоцитами, эритроцитами и др.).
Теория Шмидта–Моравитца
Способность крови свертываться с образованием сгустка в просвете кровеносных сосудов при их повреждении была известна с незапамятных времен.
Основы ферментативной теории свёртывания крови были предложены профессором Юрьевского (ныне Тартуского) университета А.А.Шмидтом (работы 1872—1895 гг.). Первоначально она сводилась к следующему: свёртывание крови – ферментативный процесс; для свёртывания крови необходимо присутствие трех веществ: фибриногена, фибринопластического вещества и тромбина.
В результате дальнейших исследований А.А. Шмидта и его школы, а также Моравитца, Гаммарстена, Спиро и др. было установлено, что образование фибрина происходит за счет одного предшественника – фибриногена.
Через 20 лет после открытия тромбина была сформулирована классическая ферментативная теория свёртывания крови, которая в литературе получила название теории Шмидта–Моравитца.
Схематически теория Шмидта–Моравитца может быть представлена в следующем виде:
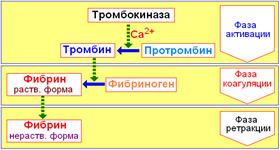
Сравнительно простая по своей сути теория Шмидта–Моравитца в дальнейшем необычайно усложнилась, обросла новыми сведениями, «превратив» свёртывания крови в сложнейший ферментативный процесс.
5. Плазменные факторы свёртывания крови
Коагуляционный гемостаз в основном обусловлен взаимодействием факторов, находящихся в плазме крови. Не случайно коагуляционный гемостаз называют также плазменным гемостазом.
Факторы свертывания обозначаются римскими цифрами по мере их открытия.
Активация фактора обозначается добавлением буквы «а»:
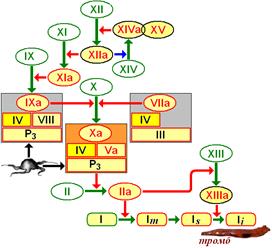
Рис. 712130040. Схема взаимодействия плазменных факторов свёртывания крови.
Познакомимся с названиями плазменных факторов, приведенных на рис. 712130040.
Фактор I — фибриноген (Ia - фибрин)
Фактор II — протромбин (IIa - тромбин)
Фактор III — тканевый тромбопластин
Фактор IV — Са2+
Фактор V — проакцелерин (Va - акцелерин) (синонимы - Ас-глобулин, лабильный фактор)
Фактор VI — исключен из классификации, поскольку выяснилось, что это фактор Va
Фактор VII — проконвертин (VIIa – корнвертин) [d]
Фактор VIII — антигемофильный глобулин А
Фактор IX — антигемофильный глобулин В [e]
Фактор X — фактор Стюарта—Прауэра[f]
Фактор XI — плазменный предшественник тромбопластина [g]
Фактор XII — фактор контакта (фактор Хагемана)
Фактор XIII — фибринстабилизирующий фактор [h]
Фактор XIV — прекалликреин (фактор Флетчера) [i]
Фактор XV — высокомолекулярный кининоген (фактор Фитцжеральда) [j]
Общая характеристика плазменных факторов свёртывание крови
Восемь факторов свертывания крови являются ферментами (II, VII, IX—XIV).
Все кроме XIII представляют собой сериновые протеазы, активирующие другие факторы путем расщепления в молекуле белка связей Apr—Лиз.
Четыре фактора (II, VII, IX, X) имеют в своем составе участки с большим количеством остатков g‑карбоксилглутаминовой кислоты, для синтеза которой необходим витамин К. Эти участки связывают ионы Са2+, с помощью которых эти факторы прикрепляются к фосфолипидам тромбоцитов и клеток поврежденных тканей, имеющим отрицательный заряд. (Для остановки кровотечения достаточно 10—15 % от нормальной концентрации большинства факторов, например, II, V—XI.)
Характеристика отдельных плазменных факторов свёртывания крови
Фактор[Мф13] I (фибриноген[Мф14] )
Стабильный[Мф15] белок-глобулин;
Молекулярная масса — 341 000 дальтон; длина молекулы 46 нм
Место синтеза — печень;
Содержание в плазме — 1.8—4.0 г/л;
Период полужизни в плазме после внутривенного введения — 4—5 дней;
Минимальный уровень, необходимый для гемостаза — 0.8 г/л;
Хромосома, кодирующая синтез — 4q23-q32.
Фибриноген является плазменным глобулином,
Молекула состоит из шести полипептидных цепей (две Аα-цепи, две Вβ-цепи и две γ-цепи). Структура фибриногена — Аα2Вβ2γ2 (рис. 712071610).
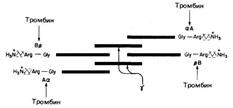
Рис. 712071610. Схематическое изображение фибриногена, его структуры (АαВβγ)2, заряженных концов, сайтов расщепления тромбином (стрелки) четырех пептидных связей Arg-Gly.
Вβ- и γ-цепи содержат сложные олигосахариды, связанные с остатками аспарагина[Мф16] (Asn). Концы молекул фибриногена обладают сильным отрицательным зарядом; это обусловлено присутствием большого количества остатков аспартата и глутамата в А-области цепи Аα и в В-области области цепи Вβ (рис. 712071610). Помимо этого В-область цепи Вβ содержит необычно отрицательно заряженный остаток тирозин-О-сульфата. Отрицательно заряженные концы молекул фибриногена не только способствуют растворимости последних в воде, они отталкивают концы других молекул фибриногена, что предотвращает агрегацию последних.
Под действием тромбина (фактор IIa), расщепляющего пептидные связи Apr—Гли, от фибриногена отщепляются четыре низкомолекулярных пептида, и он превращается в фибрин-мономер (Im), способный к аутополимеризации за счет свободных связей.
Дата добавления: 2015-08-26; просмотров: 1066;
