ДОФамин Адреналин Норадреналин
Адреналин образуется исключительно в мозговой ткани надпочечников, т.к. только в них имеется специфическая метилтрансфераза, ускоряющая метилирование норадреналина в адреналин. В свою очередь синтез метилтрансферазы в мозговом слое контролируется глюкокортикостероидами и, прежде чем попасть в общий круг кровообращения, глюкокортикоиды в большой концентрации проходят через мозговой слой. Под действием нервного импульса из этих гранул путем экзоцитоза выделяется адреналин, который попадает в окружающую внеклеточную среду, далее в кровь. Норадреналин может синтезироваться во многих органах, на окончаниях симпатической нервной системы. У плода мозговое вещество надпочечников вырабатывает большое количество норадреналина, который у него является основным гормоном стресса.
2-ая реакция - лимитирующая, активность фермента, ускоряющего эту реакцию, ингибируется норадреналином.
Поскольку в состав данных гормонов входит кольцо пирокатехина и в боковой цепи содержится аминогруппа, их называют пирокатехинами или катехоламинами, причем 80% этих веществ приходится на адреналин. Некоторыми свойствами катехоламинов обладает ДОФамин, содержащийся, главным образом, в мозговой ткани. Нарушение синтеза дофамина в черной субстанции мозга приводит к развитию двигательных расстройств – паркинсонизму. В клетках большая часть катехоламинов накапливается в особых хромаффинных гранулах, это депонированная резервная форма. Гранулы содержат до 20% адреналина, 4%-АТФ, связаны с белками, меньшая - в свободной физиологически активной форме, которая быстро разрушается под влиянием моноаминоксидазы (МАО).
При избыточном образовании катехоламинов, нарушении активности МАО и других ферментов, участвующих в метаболизме катехоламинов, развиваются различные патологические состояния. Показано токсическое действие продуктов метаболизма катехоламинов на ткань мозга при шизофрении, маниакально-депрессивном синдроме. Очень большое количество катехоламинов в моче установлено при белой горячке, а уменьшение наблюдается при олигофрении. При эпилепсии характерно резкое увеличение выведения катехоламинов с мочой во время приступа и снижение в период между приступами. Развитие атеросклероза сопровождается снижением уровня выведения катехоламинов с мочой. Развитие инфаркта миокарда связано с накоплением катехоламинов в сердечной мышце.
Механизм действия – первый. Рецепторы, к которым могут присоединиться катехоламины, бывают двух видов: a- (a1 и a2) и b- (b1, b2 и b3)-адренорецепторы, плотность их на поверхности клеток различных органов и тканей различна. В частности, b-рецепторы в больших количествах имеются на клетках сосудов мозга, сердца, печени, жировой ткани. a-рецепторов много в сосудах кишечника, периферических сосудах, в органах брюшной полости, за исключением печени. Катехоламины, связываясь с a1-рецепторами, ускоряют накопление цГМФ, активируют фосфолипазу С, что приводит к повышению IP3 и ДАГ. Катехоламины, связываясь с a2-адренорецепторами, способствуют уменьшению образования ц.АМФ, а взаимодействуя с b-рецепторами, стимулируют образование ц.АМФ. Поэтому один и тот же гормон, действуя через различные рецепторы, может вызвать противоположный эффект: образование комплекса гормон-a-рецептор ускоряет синтез гликогена и липидов, а комплекс гормон-b-рецептор вызывает их распад. Также отличается физиологическое действие гормонов на стенки сосудов, особенно коронарных и мозговых: сужение сосудов вызывает гормон, связанный с a-рецептором, а расширение - связанный с b-рецептором. Известно также, что норадреналин обладает большим сродством к a1 и β1-рецепторам, а адреналин - к α2 и b2-рецепторам. В связи с этим их действие на органы и ткани различно. Известно также, что при больших концентрациях адреналин может взаимодействовать и с a-рецепторами.
Клетки-мишени – печень, скелетная и сердечная мышцы, жировая ткань, ЦНС, мускулатура сосудов, бронхов, кишечника, мочевыделительных путей.
Физиологическое действие: поскольку адреналин способствует образованию ц.АМФ, то в клетках-мишенях повышается гликогенолиз. Образовавшиеся в печени молекулы глюкозо-6-фосфата дефосфорилируются и глюкоза поступает в кровь. В мышцах же глюкозо-6-фосфат (в виду отсутствия фермента глюкозо-6-фосфатазы) подвергается гликолизу и используется как источник энергии, чаще глюкоза в мышцах распадается до молочной кислоты, которая поступает в печень и используется на глюконеогенез. Под действием адреналина снижается поглощение глюкозы мышцами и другими органами и тканями вследствие понижения секреции инсулина, что предотвращает потребление глюкозы тканями, сохраняя ее для мозга.
В жировой ткани, печени повышается липолиз, выделившиеся СЖК в печеночный клетках подвергаются b-окислению, образуются в повышенных количествах кетоновые тела, которые поступают в кровь, а затем в мышцы и сгорают в этих клетках. Глицерин же используется на глюконеогенез.
Расширение сосудов сердца, мозговой ткани улучшает кровоснабжение этих органов, способствует лучшему энергообеспечению тканей, увеличивает потребление кислорода, повышает окислительно-восстановительные процессы, вследствие чего резко увеличивается работоспособность сердечных и скелетных мышц. Значит, адреналин приводит организм в состояние готовности к борьбе, ускоряя ритм сердца, увеличивая сердечный выброс и повышая кровяное давление, подготавливает тем самым сердечно-сосудистую систему к активности в экстремальной ситуации. Т.о. адреналин обладает кардиотоническим, гипергликемическим, калоригенным действием, т.к. способствует максимальному обеспечению органов и тканей, в частности нервной системы и мышц, легко утилизирующимися энергетическими субстратами — глюкозой и кетоновыми телами. Это приводит к повышению использования тканями кислорода и повышению обмена веществ, интенсификации тканевого дыхания.
Процессы, происходящие под действием адреналина в органах и тканях, можно суммировать в виде таблицы
Метаболический и физиологический ответ на адреналин
| Орган (ткань) | Биохимические процессы |
| Мозг | Усиление кровотока и поступления глюкозы и кетоновых тел; повышение метаболизма глюкозы |
| Сердечно-сосудистая система | Увеличение силы и частоты сокращения; периферическая вазоконстрикция; расширение коронарных сосудов |
| Легкие | Бронходилатация; усиление вентиляции |
| Мышцы | Повышение интенсивности β-окисления СЖК и гликогенолиза; увеличение сократимости |
| Печень | Повышение продукции глюкозы (вследствие усиления глюконеогенеза и гликогенолиза, снижения синтеза гликогена, усиление b-окисления, повышение синтеза кетоновых тел) |
| Жировая ткань | Повышение липолиза |
| Кожа, скелет, ЖКТ, мочеполовая система, лимфоидная ткань | Снижение кровотока, потребления глюкозы и синтеза белка; повышение протеолиза; полиурия |
Нарушение синтеза адреналина в мозговой ткани сопровождается болезнью Паркинсона.
Норадреналин, действуя через a-рецепторы, сужает сосуды брюшной полости и периферические артерии. При этом повышается артериальное давление. Адреналин, действуя через b-рецепторы, расширяет сосуды мозга, печени и сердца. В результате кровоток в этих органах улучшается. Таким образом, под действием катехоламинов, при стрессе происходит перераспределение кровотока, что повышает адаптативные способности организма к воздействию стресса.
Кай Юлий Цезарь заметил, что на опасность, как сказали бы сейчас, на стресс, люди реагировали по-разному. Некоторые бледнели, вследствие того, что резко сокращались сосуды кожи и другие периферические сосуды, что повышало как систолическое, так и диастолическое артериальное давление, что, в свою очередь, рефлекторно приводило к выраженной брадикардии. Так сказывается действие норадреналина. Другие люди краснели, у них повышалась работоспособность, резко усиливались обменные реакции. У них преобладали b-рецепторы и больше вырабатывалось адреналина, чем норадреналина. Если адреналин усиливает процессы возбуждения, то норадреналин – процессы торможения. Поэтому люди, краснеющие в минуты опасности, более агрессивны и активны, чем бледнеющие. Установлено, что краснеющие люди живут дольше.
При длительном воздействии стресса наблюдаются нарушения. Это объясняется тем, что у больных резко повышается концентрация адреналина, поэтому адреналин связывается не только с b-, но и с a-рецепторами. В результате сужаются периферические сосуды, а также сосуды сердца, мозга, в которых также имеются a-рецепторы. Такое состояние может вызывать инфаркты или инсульты.
Обобщая, можно сказать, что норадреналин выделяется в тех случаях, когда требуется перестройка гемодинамики, перераспределение крови, а адреналин — в тех случаях, когда нужно изменить обмен веществ в ответ на боль, травму и другие воздействия.
Глюкокортикостероиды – образуются в пучковой зоне коры надпочечников. В настоящее время из коры надпочечников выделено около 100 различных производных холестерина, называющихся кортикостероидами. Однако биологической активностью обладают десять из них, остальные представляют продукты синтеза и распада кортикостероидов.
Химическая природа: Они производные холестерина. Общим признаком всех кортикостероидов является наличие в них кольца циклопентанпергидрофенантрена, присутствие двойной связи между С4 и С5 и кетогруппы у С3. У С10 и С13 - метильная группа.
Механизм действия — все кортикостероиды действуют по II механизму, их рецепторы находятся внутри клеток. Гормон-рецепторный комплекс связывается со специфическими последовательностями ДНК, что приводит к усилению скорости транскрипции определенных генов и, как следствие, повышению синтеза белков и ферментов. Поэтому действие кортикостероидов отсроченное – начинается через 12-24 часа и достигает максимума через 10-12 дней (гормоны адаптации).
По влиянию на обмен веществ и по месту образования кортикостероиды делятся на 3 группы: в 1-ом слое (клубочковой зоне) образуются минералокортикостероиды (МКС), во 2-ом слое (пучковой зоне) - глюкокортикостероиды (ГКС), в 3-ем слое (сетчатой зоне) –андрокортикостероиды (АКС). Деление это условное, т.к. гормоны каждой группы, обладая мощным специфическим действием, оказывают еще действие гормонов другой группы. Это объясняется большим сходствам строения. АКС подобны мужскому половому гормону - тестостерону.
Наиболее активными ГКС являются кортизол (гидрокортизон) -70%, кортикостерон (10%), менее активным является кортизон (20%). У человека, обезьяны и собаки в большом количестве синтезируется кортизол, а у крыс и кроликов – кортикостерон.
В плазме крови большая часть кортизола связывается со специальным белком типа глобулинов - транскортином и сывороточным альбумином. Связывание ГКС с белками плазмы повышает их растворимость, облегчает их транспорт к органам и тканям, временно инактивирует, защищает от разрушения.
Химическая природа: кортизол и кортизон у С17 имеют OH-группу и
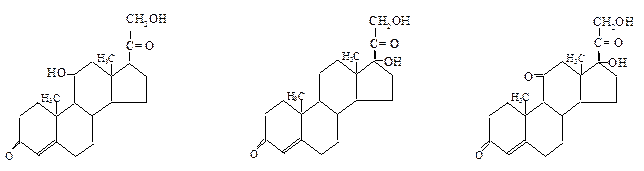 Кортикостерон Кортизон Кортизол
Кортикостерон Кортизон Кортизол
поэтому называются 17-оксикортикостероиды - (17-ОКС). Кортизол и кортикостерон имеют ОН-группу при С11 и называются 11-ОКС. У кортизона у С11 имеется кетогруппа. Таким образом, у всех кортикостероидов при С11 в той или иной форме присутствует кислород, и это определяет их биологическое действие, влияние на обмен веществ.
 Клетки-мишени: клетки кожи, печени, тимуса, селезенки, жировой, лимфоидной, соединительной и мышечной тканей.
Клетки-мишени: клетки кожи, печени, тимуса, селезенки, жировой, лимфоидной, соединительной и мышечной тканей.
Физиологическое действие:
Общая направленность– катаболическая, в печени - анаболическая.
Влияние на белковый обмен: под влиянием ГКС повышается распад белков во всех клетках-мишенях, кроме печени, поэтому в крови увеличивается содержание аминокислот. Часть поступивших в печень аминокислот под влиянием трансаминаз и оксидаз аминокислот, синтез которых усиливается под влиянием ГКС, подвергаются непрямому дезаминированию. Образующиеся безазотистые остатки аминокислот используются на глюконеогенез, т.к. особенно много синтезируются в печени ферментов, участвующих в глюконеогенезе. А из аммиака образуется мочевина. В печени усливается синтез белков.
Влияние на углеводный обмен: под влиянием ГКС повышается активность глюкозо-6-фосфатазы и тормозится активность глюкокиназы печени, следовательно, глюкоза в печени не утилизируется, а имеющиеся молекулы глюкозо-6-фосфата дефосфорилируются, поэтому глюкоза используется на гликогеногенез, тем более что ГКС способствуют образованию в печени гликогенсинтетазы. Но скорость глюконеогенеза превышает намного скорость гликогеногенеза, поэтому в кровь выходит глюкоза, возникает гипергликемия, которая может вызвать глюкозурию.
Под действием ГКС угнетается превращение пирувата в ацетил-КоА, поэтому в крови много лактата.
Влияние на проницаемость сосудов: ГКС понижают проницаемость клеточных и внутриклеточных мембран, возможно через подавление активности гиалуронидазы, поэтому глюкоза не может проникнуть в клетки различных органов. Исключение составляют ткани головного мозга, в которых глюкоза используется и как источник энергии, и как источник для образования ацетилхолина.
Влияние на липидный обмен: в области нижних конечностей и нижней части туловища в жировой ткани ГКС тормозят липонеогенез, повышают липолиз, в результате в крови увеличиваются содержание СЖК, возрастает поступление их в печень, где они подвергаются b-окислению. Из ацетилКоА, которая при этом образуется, синтезируются кетоновые тела. А глицерин в печени идёт на глюконеогенез.
В области лица и верхней части туловища ГКС повышают липогенез, увеличивая жировые отложения в указанных частях тела.
Taким oбpaзом, под влиянием глюкокортикоидов во всех клетках-мишенях замедляется утилизация (окисление) глюкозы; гликогеногенез, осуществляемый в печени, не может компенсировать усиленный глюконеогенез, в результате глюкоза поступает в кровь, вызывая гипергликемию, а затем глюкозурию. Это направлено на адаптацию организма к стрессу. Мышцы активно утилизируют глюкозу и СЖК, тогда как мозг в основном окисляет глюкозу и частично кетоновые тела. Эритроциты используют исключительно глюкозу.
Влияние на иммунную систему: Глюкокортикостероиды вызывают иммуносупрессию, т.к. в вилочковой железе и селезенке вызывают инволюцию лимфоидной ткани, лизируют тимоциты, тормозят выработку антител, останавливают дифференцировку Т-лимфоцитов. Угнетение лимфоидной ткани связано с ингибированием в ней митотической активности и синтеза РНК. Уменьшают связывание макрофагами антигенов. ГКС угнетают миграцию и хемотаксис лейкоцитов, фагоцитоз и синтез интерферона. Поэтому после лечения ими понижается резистентность организма к инфекциям.
Влияние на развитие воспаления: ГКС ингибируют выделение гистамина и серотонина, оказывая выраженное противо-воспалительное действие. Этот эффект ГКС обусловлен тем, что:
-они уплотняют мембраны клеток и препятствуют освобождению из фосфолипидов арахидоновой кислоты за счет ингибирования транскрипции гена фосфолипазы А2. В результате этого снижается образование простагландинов, лейкотриенов, тромбоксанов – веществ, способствующих воспалению;
-они уменьшают уровень кининов вследствие стимулирования синтеза пептидаз, разрушающих кинины;
-подавляют приток лейкоцитов в очаг воспаления и уменьшают местное разрушение фибробластов;
-они ингибируют синтез пролилгидроксилазы, в результате уменьшается образование оксипролина, который необходим для синтеза коллагена, следовательно, тормозится образование рубцовой ткани. ГКС вызывают уменьшение роста и активности фибробластов, что ведет к нарушению синтеза коллагена, задержке замены дифференцированной ткани соединительной тканью, замедляется заживление ран.
Пермиссивный эффект ГКС. Они сенсибилизируют артериолы к
действию норадреналина, участвуя в поддержании артериального давления. Предполагается, что кортизол способствует расширению сосудов почек, в результате усиливается клубочковая фильтрация и экскреция воды с мочой.
ГКС обладают разрешающим эффектом на экскрецию воды; необходимы для инициации диуреза в ответ на нагрузку жидкостью.
Кортизол тормозит секрецию СТГ и инсулиноподобного фактора роста и уменьшают синтез белка, следовательно, при гиперкортицизме наблюдается задержка роста.
ГКС препятствуют действию витамина Д на всасывание кальция и усиливают экскрецию кальция, замедляют рост. Таким образом, ГКС применяются как противовоспалительные и антиаллергические препараты.
Регуляция синтеза гормонов коркового и мозгового слоя надпочечников
Образование и секреция гормонов коркового и мозгового слоя надпочечников тесно связаны. В ответ на нервный стимул под действием ацетилхолина увеличивается секреция катехоламинов. При этом в головном мозге увеличивается секреция серотонина. Любая активация симпатической нервной системы, особенно при стрессе (травмы, опасность, гипогликемия, боль, физическая нагрузка, гипертермия) ведет к массированному выделению катехоламинов. При сильном стрессе уровень катехоламинов в крови возрастает в 4-5 раз.
Под действием катехоламинов и серотонина в гипоталамусе увеличивается образование кортикотропин-рилизинг-фактора, который, действуя на переднюю долю гипофиза, способствует секреции АКТГ. Секреция АКТГ ингибируется опиатами, ГАМК-ергическими нейронами и ГКС. Последние наиболее сильно ингибируют продукцию АКТГ и подавляют секрецию кортикотропин-рилизинг-фактора. АКТГ повышает секрецию кортикостероидов, в основном ГКС и в меньшей степени минералокортикоидов. Кортикостероиды, в свою очередь, попадая в мозговой слой надпочечников, активируют метилтрансферазу, которая способствует образованию из норадреналина адреналина.
На секрецию норадреналина влияет ацетилхолин. Считают, что ацетилхолин повышает проницаемость мембран постсинаптических клеток, усиливая поступление кальция внутрь клеток. Это приводит к излиянию катехоламинов в синаптическую щель.
На секрецию альдостерона влияют концентрации натрия и калия в крови. Снижение натрия в крови приводит к повышению альдостерона, а калия — к уменьшению. Большую роль в секреции альдостерона имеют почки, в которых при понижении артериального давления, кровопотерях, ишемии образуется фермент ренин. Он ускоряет превращение белка плазмы крови ангиотезиногена в ангиотезин 1 (декапептид), который под действием ангиотензинпревращающего фермента (АПФ) переходит в ангиотезин II.Последний действует на кору надпочечников по первому механизму, повышая активность протеинкиназы С. Это приводит к повышению кальция в цитоплазме клеток-мишеней и активации цитохрома Р450, что сопровождается повышением образования и секреции альдостерона.
Соматотропный гормон (СТГ).
Химическая природа: гормон является простым белком, состоящим из 191-го аминокислотного остатка, обладает видовой специфичностью, т.е. на человека оказывает влияние только человеческий СТГ или СТГ человекообразных обезьян.
Механизм действия:
Сложный, гормон действует по первому и третьему механизмам. Свое действие опосредует через тирозинкиназно-фосфатазный каскад (пролиферативный эффект); фосфатидилинозитидную систему и соматомедины (метаболические эффекты). Под действием гормона роста в печени образуются соматомедины трёх типов - А, В, С. Соматомедины типов А и С действуют подобно инсулину на хрящевую, соединительную и костную ткани, а соматомедины типа В - на ЦНС. Обладают инсулиноподобным эффектом, который проявляется тем, что под влиянием соматомединов усиливается проницаемость клеток-мишеней, уменьшается активность аденилатциклазы. При этом соматомедины А и С типов ускоряют пролиферацию клеток хрящевой ткани, усиливают синтез ДНК, РНК и белка в костной и соединительной ткани, такой же эффект, но в нервной ткани, оказывает соматомедин типа В.
Клетки-мишени СТГ – все клетки организма.
Физиологическое действие:
Действие гормона заключается в следующем:
- стимулирование пролиферации клеток-мишеней. Это связано с тем, что СТГ стимулирует в печени образование соматомединов и в небольшой степени инсулина (инсулиноподобный эффект). При этом усиливается включение аминокислот, уридина, тимидина и сульфатов в клетки хряща и происходит ускорение синтеза белков, нуклеиновых кислот и пролиферации хондроцитов и клеток всех других тканей;
- метаболические эффекты: вначале (в течение 30-40 минут) СТГ стимулирует проникновение глюкозы в клетки и ее окисление в них, но затем проявляет контринсулярный эффект на обмен углеводов – снижается использование глюкозы жировыми и мышечными клетками, повышается глюконеогенез в печени. Подобным образом влияет на обмен липидов – в течение 30 - 40 минут проявляет инсулиноподобное действие – усиливает липогенез, в дальнейшем снижает синтез липидов в жировой ткани, понижает захват глюкозы печенью и жировой тканью, усиливает освобождение свободных жирных кислот в кровь, т.е. усиливает липолиз и оказывает кетогенное действие;
- СТГ действует на поджелудочную железу, усиливая выработку глюкагона;
- действуя через фосфатидилинозитидную систему, гормон способствует понижению кальция во внеклеточной среде, в т.ч. в крови.
Т.о., СТГ оказывает инсулиноподобное действие на мышцы (кратковременный эффект), но в условиях длительного воздействия в больших дозах этот гормон вызывает инсулинорезистентность и проявляет диабетогенное действие. Это действие также проявляется в том, что СТГ повышает продукцию глюкозы печенью и снижает захват глюкозы тканями. Поэтому СТГ в большей степени можно отнести к контринсулярным гормонам. Двухфазовое действие СТГ (инсулиноподобное и контринсулярное) позволяет усиливать рост и анаболизм, не расплачиваясь за это гипогликемией и снижением катаболизма.
Выработка СТГ увеличивается:
- при глубоком сне на ранних стадиях (медленнофазовом сне –
когда «летишь во сне»);
- после воздействия пирогенов и в связи с травмой;
- после мышечных упражнений;
- при гипогликемии;
- после введения аргинина;
- после введения вазопрессина;
- после введения наркотических анальгетиков.
Секреция СТГ стимулируется соматолиберином , а также тиролиберином, b-эндорфином, допамином, серотонином, норадреналином, ацетилхолином. Секреция тормозится соматостатином, адреналином и СЖК плазмы крови. Гормон выделяется импульсно, в сутки 4-10 раз. Усиливают высвобождение СТГ эстрогены и глюкагон, а прогестерон снижает образование СТГ.
Нарушение секреции СТГ: гиперпродукция гормона наблюдается 1.при доброкачественной опухоли аденогипофиза, 2. у некоторых беременных перед родами. Гиперпродукция гормона у взрослых проявляется акромегалией (увеличение размеров некоторых частей тела – кистей, носа и др.
У детей гиперпродукция СТГ приводит к гигантизму. Гипопродукция гормона опасна для детей и проявляется развитием карликовости (в отличие от детского гипотиреодизма, характеризующегося развитием карликовости с умственным нарушением – кретинизмом, при недостатке СТГ у детей нарушается только рост – «умный карлик»).
Изменения эндокринной функции поджелудочной железы
могут проявляться в виде гипер- или гипофункции.
Гиперфункция поджелудочной железы
Повышение продукции инсулина наблюдается при доброкачественной опухоли поджелудочной железы. При передозировке инсулина появляются такие же признаки, что и при гиперпродукции инсулина. При этом наблюдается гипогликемия, которая проявляется слабостью вплоть до потери сознания, повышенной потливостью, понижением зрения. Неотложная помощь при таком состоянии– введение глюкозы внутривенно или (если больной в сознании) кусочек сахара под язык.
Гипофункция поджелудочной железы проявляется сахарным диабетом. По механизму возникновения сахарный диабет делится на: 1) инсулинзависимый - ИЗСД; 2) инсулиннезависимый – ИНСД.
ИЗСД возникает при недостатке инсулина.
ИНСД наблюдается чаще и связан с потерей чувствительности клеток-мишеней к инсулину.
По проявлению сахарный диабет делится на:
1) тучный, или жирный, который возникает в тех случаях, когда в организме отсутствует свободный инсулин, а связанный инсулин есть; 2) тощий, или истинный диабет проявляется, когда отсутствует и свободный и связанный инсулин.
При истинном сахарном диабете во всех клетках повышается липолиз, т.е. жировая ткань тает, происходит похудение. При тучном диабете действие инсулина сохраняется в жировой ткани, где усиливается липогенез – наблюдается ожирение.
Дата добавления: 2015-07-14; просмотров: 7017;
