Ферменттердің сипаттамасы
1836 жылы Т. Шванн асқазан сөлінен ақуыздарды ерітіп, ыдырататын затты бөліп алды. Ол пепсин еді. Сол жылы Я. Берцелиустың жұмысы жарыққа шықты. Онда: «Бізде өсімдіктер мен жануарлардың тіндері мен сұйықтықтары арасында көптеген түрлі ыдырауды шақыратын мыңдаған катализдік үрдістер жүретіні туралы жеткілікті дәлелдер бар. Келешекте, олар дене ағзаларын құрайтын тірі тіндердің катализдік күшін табуға үміттеміз» - деп жазған.
Микробтық, өсімдік және жануар табиғатының ферменттері биопрепараттар ретінде медициналық тәжірибеде адамның әртүрлі ауруларында диагностикалық және емдік мақсатта қолданады. Олар, әсіресе, организмде белгілі бір ферменттер мүлде болмауы не оның жеткіліксіздігінен туындаған тұқым қуалайтын патологияны емдеуде тиімді.
Ферменттер биотехнологиясының міндеттері:
- адам ауруларының емі мен алдын алу үшін ферменттік препараттарды алу технологиясын жасау;
- ферменттердің каталитиздік белсенділігі мен стереоталғамдылығына негізделген аналитикалық әдістерін, диагностикалық тест-жүйелерін жасау;
Ферменттер – барлық тірі ағзалардың негізгі жұмыс құралдары. Олар тірі ағзада өтетін барлық химиялық реакцияларға жауап береді: энергия және құрылыс материалдарымен қамтамасыз етеді; өмірлік үрдістерді реттеуге қатысатын сигналдық молекулаларды құрылуына және ыдырауына қатысады; организмді бөтен заттардан қорғайды. Сонымен қатар, ферменттер тұқым қуалау ақпараттарын қайта жазып көбейтуге, яғни ДНҚ мен РНҚ синтездеуге қатысады. Осы ақпараттың жүзеге асуына, яғни өз-өзінің және басқа ақуыздардың синтезделуіне қатысады.
Ферменттер басқа глобулалы ақуыздар сияқты рибосомаларда синтезделінеді, клетка ішінде қызмет атқарады (эндоферменттер), не сыртқы ортаға бөлінеді (экзоферменттер). Көптеген эндоферменттер цитоплазмада еріген түрінде бола тұра, клеткада бос күйінде жүреді; басқалары күрделі жоғары реттелген құрылымдармен байланыста болады. Клеткалардың ферментті жиыны типті, түрге сипатты, генетикалық детерминацияланған. Сонымен қатар, клеткада арнайы әрқашан бір концентрацияда болатын конститутивті (өмірлік маңызды, жиі эндогенді) және концентрациясы субстраттың болуына байланысты индуцибельді ферменттерді ажыратады. Клетка индуцибельді ферменттерсіз де өз тіршілігін сақтай алады. Ферменттер клетканың функционалды ақуыздарының негізгі массасын құрайды. Кейбір энзимдер үшін белсенді қызмет уақыты 20 минуттан аспайды, кейіннен олар алмастырылуы керек. Басқа энзимдер ыдырап, организмнен жойылғанға дейін бірнеше апта бойы белсенді болып қалады. Ферменттер химиялық катализаторлардан да тиімді, одан бөлек олар таңдамалырақ: күрделі қоспалардан бір затты бөліп алып, оны бірнеше емес, бір өнімге айналдыра алады.
Ферменттер құрылысын оқып-зерттеудің негізін салған Д. Самнер, ол бірінші болып ферменттердің ақуыздық табиғатын ашқан. Осы уақытқа дейін кристалды түрінде 150-ге жуық ферменттер сипатталған, яғни олардың құрылысы ашылған.
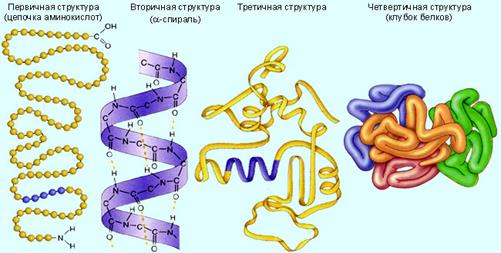
Басқа ақуыздар тәрізді, ферменттер біріншілікті, екіншілікті, үшіншілікті және төртіншілікті құрылысымен сипатталады:
- біріншілкті құрылысы – бұл бір-бірімен пептидті байланыспен байланысқан аминқышқылдар реті;
- екіншілікті құрылысы – тізбектің басқа бөлімдеріндегі СО- және NH топтары арасындағы сутекті байланыс арқылы полипептидті тізбектің конформациясын спираль түрінде реттейді;
- үшіншілікті құрылысы – полипептидті тізбектің глобулаға фрагмент молекуласының гидрофобты ядросын түзу арқылы арнайы ретпен көрінеді. Химиялық байланыстың барлық түрлерін тұрақтандырады. Күшті байланыстар – пептидті және дисульфидті; әлсіз – сутекті, гидрофобты және электростатикалық;
- төртіншілікті құрылысы – екі және одан көп глобулалы бірліктердің ассоциациясы нәтижесінде құрылады.
Ферменттердің біріншілікті құрылысын секвенирлеу әдісі арқылы анықтайды – полипептидті тізбектегі аминқышқылдар реттілігін анықтау (наносаңылаулар арқылы полипептидті тізбекті өткізу жолымен ақуыздың біріншілікті құрылысын детекциялау әдісі жасап шығарылады; ол арқылы өткенде белгілі бір аминқышқылдарына детекцияның сәйкес сигналы беріледі). Ферменттердің үшіншілікті құрылысын рентгенқұрылымды анализ арқылы анықтайды.
Біріншілікті құрылысы (аминқышқылдар тізбегі) Екіншілікті құрылысы (альфа-спираль) Үшіншілікті құрылысы Төртіншілікті құрылысы (ақуыз глобуласы)
44-сурет. Ақуыздың құрылысы
Фермент құрылысында белсенді орталық пен аллостериялық, яғни «басқа кеңістікті құрылысы бар» орталықты ажыратады. Фермент белсенді орталығы кеңістікте жақындасқан әртүрлі полипептидті тізбек немесе полипептидті тізбектің әртүрлі бөлімдерінің құрамында орналасқан аминқышқыл қалдықтарынан құралған. Ақуыз-фермент үшіншілікті құрылысының деңгейінде құралады. Белсенді орталық субстратпен арнайы өзара байланысатын полярлы емес химиялық топтардың бірлестігімен көрінеді. Оның полипептидті басқа бөлімдерінен ерекшелініп тұратын арнайы топографиялық шекарасы жоқ. Ферменттердің белсенді орталықтарына протондардың донорлары (-COOH, -NH3, -SH) немесе акцепторлары (-COO, -NH2, -S-) болып табылатын арнайы аминқышқылды қалдықтар енеді.
Белсенді орталықтың бір түрі әртүрлі ферменттерде қолданылуы мүмкін. Осылайша, ДНҚ гидролиздейтін ферменттер (экзонуклеаза мен эндонуклеазалар) суды магний иондарының карбоксильді топтар кешенінің көмегімен белсенеді де, фрагменттерге ыдырайтын ДНҚ қосады. Белсенді орталық осындай түрінде ДНҚ-полимераза ферменті болады, бірақ ол фосфатты топтар арқылы екі негізді тігеді. Сол белсенді орталық, бірақ суды емес, негіздің қантты қалдығының гидроксильді тобын белсендіреді. Сондықтан, ДНҚ фрагменттерге ыдыратудың орнына, керісінше, фрагменттерден ДНҚ толық молекуласын түзу арқылы байланысу орынды.
Егер ферменттің субстратпен өзара әрекеттестігінің талғамдылығы белсенді орталық қасиетіне негізделген болса, онда аллостериялық орталықтың ферменттің каталитиздіқ белсенділігін реттеуде маңызы бар. Аллостериялық орталық фермент молекуласының бір бөлігі болып келеді, оған төмен молекулалы қосылыстар - тежеушілер не эффекторлар қосылғанда, ақуызды молекуланың үшіншілікті құрылысы өзгереді. Осының нәтижесінде белсенді орталықтың конфигурациясы өзгереді, ол ферменттін катализдік белсенділігінің артуымен не төмендеуімен көрінеді.
Фермент пен субстрат арасындағы кеңістікті өзара әрекетті түсіндіру үшін Э. Фишер «құлыпқа кілт» моделін ұсынды. Кейіннен ферментті реакциялар кинетикасын түсіндіру үшін түрлі математикалық модельдер жасап шығарылды (Моно, Михаэлис және т.б.). 1948 жылы Л. Полинг артынан тәжірибелік түрде дәлелденгендей, ферменттердің каталитиздіқ әсері химиялық реакциялардың ауыспалы жағдайы ферменттің белсенді орталығымен әрекеттесу арқылы тұрақтандырылады деп болжады. «Индуцияланған сәйкестік» гипотезасы бойынша (Кошланд моделі), ферментативті белсенділік реакция өнімі немесе субстрат молекуласынан айрықша аздаған молекулалармен реттелуі мүмкін. Аллостериялық орталықтардың болатыны көрсетілді, фермент белсенділігін реттейтін әдістер жасап шығарылды.
Ферменттердің қасиеттері:
- ферменттер әсерінің жоғары тиімділігі. Олар реакцияны 108 -1012 есе жылдамдата алады;
- ферменттер реакция соңғы өнімдерінің құрамына кірмейді, яғни олар жұмсалмайды (бірақ кейбір ферменттер реакцияның соңында өзгермеген күйінде босап шықпай, модификацияға, кейде ыдырауға ұшырайды). Ферменттің өте аз мөлшері субстраттың көп мөлшерінің ыдырауын катализдейді;
- ферменттердің субстрат (субстраттық талғамдылық) пен катализдеуші реакция типіне (әсер ету талғамдылығы, яғни химиялық реакцияның тек белгілі түрін ғана катализдеу мүмкіндігі) жоғары талғамдылығы; ферменттердің субстратқа талғамды әсері субстрат пен фермент молекулалары арасындағы конформациялық және электростатикалық комплементарлыққа және белсенді орталықтың ерекше құрылысына негізделген. Кейбір ферменттер тобында әлсіз әсер ету талғамдылығы байқалады, бұл топтық талғамдылығы бар ферменттер. Олардың әсер ету талғамдылығы субстрат молекуласындағы химиялық байланыс түріне байланысты. Осылайша, пепсин өсімдік және жануар табиғатының ақуыздарын олардың химиялық құрылысы мен аминқышқылдық құрамы, сондай-ақ, физикалық-химиялық қасиеттеріне қарамай, ыдырата алады. Алайда, пепсин көмірсу мен майды ыдыратпайды. Бұл пепсиннің пептидті – СО-NH - байланысына әсер етуімен түсіндіріледі. Басқа топтық талғамдылығы бар липаза-ферменттері глицерин мен май қышқылына дейін гидролизін катализдейтін липазаның әсер ету орны күрделі эфирлі байланыс болып табылады.
Моноталғамдық ферменттердің тек бір ғана субстраттың өзгеруін катализдейтін мүмкіндігі бар (мысалы, СО2 ыдырауын катализдейтін бактериалық аспартатдекарбоксилазаның стереохимиялық талғамдылығы тек L-аспарагин қышқылынан L-аланинге айналуын қамтамасыз етеді);
- ферменттердің биокатализаторлар ретінде аллостериялық реттелуі; ферментті реакцияның ингибиторлары мен эффекторларына сезімталдылығы; ферментті реакцияның жылдамдығына табиғаты органикалық және бейорганикалық заттар белсендіруші әсер етеді. Осылайша, тұз қышқылы асқазан сөлі пепсинінің әсерін белсендіреді; өт қышқылы панкреатты липазаның белсенділігін жоғарылатады; кейбір тіндік ферменттер (оксидоредуктаза, катепсиндер, аргиназа), өсімдікті протеиназа және т.б. бос SH-тобы бар қосылыстармен, тағы басқа ферменттер тобы – С дәруменімен белсендіріледі. Активаторлар ретінде көбінесе екі валентті металл иондары, аздап бір валентті металл иондары (Co, Mg, Zn, Fe, Ca және т.б.) атқарады. Аниондар физиологиялық концентрацияда тиімді емес немесе ферменттерге аз ғана белсендіргіш әсер етеді. Осы топқа кірмейтіндер - пепсин, аниондармен белсенетін кейбір оксиредуктазалар, сондай-ақ хлор иондарының әсерінен белсенділігі жоғарылайтын крахмал гидролизін катализдейтін сілекей амилазасы және галоген аниондарымен белсенетін аденилатциклаза. Ингибиторлар немесе антиферменттер каталитикалық реакцияның (біртіндеп немесе толық) тежелуін тудырады: трипсин ингибиторлары - соя және сарысулы антитрипсин, антифермент орнитиндекарбоксилаза;
- температура, рН, ерітіндінің ионды күші және т.б. сияқты ортаның физикалық-химиялық спецификалық емес факторларына ферменттердің сезімталдылығы жоғары; термолабильділік және рН-тәуелділік (рН көрсеткіші субстраттың ферментке туыстық сәйкестігіне, ферменттің субстратпен қанығуына, оның құрылымының тұрақтылығына әсер етеді).
Ферменттердің жіктелуі
6000-нан аса ферменттер белгілі, олар белгілі катализдеу реакцияларының саны бойынша 6 класқа және белгілі бір типті белсенді орталықтар санына бөлінген. Осылайша, 3000 белгілі ферменттердің ішінен шамамен 1100-гидролаза, оның бар-жоғы 5 түрлі белсенді орталығы бар.
1961 жылы ферменттердің номенклатурасы бойынша халықаралық комиссия 5-ші халықаралық биологиялық конгреске қатал ғылыми принципке негізделген номенклатура проектісін ұсынды: ферменттердің аталуы субстраттың химиялық аталуынан және ферментпен жүргізіліп жатқан реакцияның атауынан құралады. Егер ферментпен жылдамдатылатын химиялық реакция субстраттан акцепторға атомдар тобының ауысуымен қатар жүрсе, ферменттің атауына сондай-ақ, акцептордың химиялық атауы қосылады. Мысалы, мочевина гидролизі реакциясын көміртек оксиді мен аммиакқа жылдамдататын уреаза (тривиальді атауы) ғылыми номенклатурада карбамид-амидогидролаза деп аталады. Трегалаза гидролиз реакциясын жылдамдататын трегалоза трегалоза-1-глюко-гидралаза деп аталады. Кейін әр ферментке жеке нөмір (шифр) беріледі (уреаза - 3.5.1.5.). Бұл уреазаның ферменттердің барлық қалған өкілдері гидролиз реакциясын катализдейтін 3-класқа жататынын көрсетеді. Екінші сан (5) осы кластың 5-подкласына жататынын көрсетеді, мұнда пептидті болып табылмайтын C-N- байланыс гидролизін жылдамдататын барлық ферменттер енгізілген. Үшінші сан (1) уреазаның 5-подкласының подподкласына жататынын көрсетеді, олардың мүшелері сызықты амидтердің гидролизін жылдамдатады, ал соңғы сан (5)- осы подподкластағы уреазаның реттік нөмірі.
Алдыңғы қабылданған соңына «аза» жалғау арқылы жасалатын ферменттерді заты бойынша атау принципі ортақ болып қала бермек.
Катализдеу реакция типіне байланысты ферменттер 6 класқа топтастырылады:
- тотығу-тотықсыздану реакцияларына жауапты оксидоредуктазалар (глюкооксидаза, каталаза, дегидрогеназа және т.б.);
- трансферазалар, химиялық (функционалды) топтардың бір субстраттан екіншісіне тасымалдануын катализдейді (протеинкиназа, пируваткиназа, ацетилтрансфераза, фосфотрансфераза және т.б.);
- гидролазалар субстраттың химиялық байланыстарын гидролиздейді, ыдыратады (амилаза, протеиназа, целлюлаза, пектиназа, липаза және т.б.);
- лиазалар субстратқа химиялық топтарды қосу немесе алып тастауын катализдейді (аспартаза, фумараза және т.б.);
- изомеразалар, субстраттың бір молекуласы көлемінде құрылымдық өзгерістерін не изомерленуін жүзеге асырады (глюкоизомераза, триозофосфатизомераза және т.б.);
- лигазалар, қарапайымнан күрделі қосылыстардың энергия жұмсау арқылы синтезделуіне жауапты (ДНҚ-лигаза, аспарагинсинтетаза, пируваткарбоксилаза және т.б.).
Дата добавления: 2015-07-14; просмотров: 8935;
