Инсулин, бөліп алу технологиясы
1869 жылы берлинде 22 жасар медик студенті П. Лангерганс микроскоппен ұйқы безі құрылысын зерттеуде бұрын соң белгілі болмаған топтар құрып орналасқан клеткаларды көреді, олар бүкіл бездің бойында бір келкі таралған. Кейін оларды «Лангерганс аралықтары» деп атаған. 1901 жылы ұйқы безінде осындай «аралықтар» зақымдануынан қант диабеті дамуы жүретіні айтылды.
ХХ ғасырдың 20-шы жылдар басында қант диабетімен ауыратын жас адамдарда, яғни инсулинді қажет ететіндерде ұзақ өмір сұруге ұміттері жоқ еді. 1921 жылдың күзінде Торонто қаласында (Канада) Ф. Бантинг және Ч. Бест дәрігерлері бұзаулардың ұйқы безінен алынған белгілі заты иттерде экспериментальды диабетінде қанның қант деңгейін төмендеткен. 1922 жылдың 11 қантарында иттерге көптеген нәтижелі сынақтарынан кейін диабетпен сырқаттанатын 14 жасар ер баласына инсулиннің бірінші тарихи инъекциясы енгізілді. Келешекте олар Нобель сыйлығын алды, ал Бантингтің туған күнін Халықаралық диабет күні (14 қараша) деп аталып өтеді.
Инсулинді ұйқы безінің Лангерганс клеткалары синтездейді, гормон организмде көмірсу алмасуын реттейді, клеткалар глюкозаны сіңіруін қамтамасыз етеді, оның жеткіліксіздігі қант диабетіне әкеледі. Ф. Сенгер алғаш рет инсулиннің біріншілікті құрылысын немесе молекуласында амин қышқылдардың нақты жүйелі қатарын ұсынған. Кейін Д. Ходжкин рентгендік дифракция әдісі көмегімен инсулиннің кеңістіктегі молекула құрылымын тапты (екіншілік-төрттік құрылысы).
Инсулиннің бірінші препараттары жануарлар текті болды. 1922 жылдан бастап диабет емдеуіне шошқаның және бұқаның инсулині қолданылды. Технологиясы ұйқы безден инсулин-нәруызды экстракциялауына негізделген болатын (ұйқы бездің 800-1000 кг-нан 100 грамм кристалды инсулин алынатын).
Нәруызды-пептидті гормондар синтезі процесінде эндокринді бездер клеткаларында алдымен гормонды белсенділігі жоқ полипептидтер түзіледі. Полипептид құрамында нақты гормонның аминқышқылды жүйелі қатардан тұратын фрагменттер бар. Осындай нәруыздық молекуланы бастауыш-жақын-гормон деп аталады және өзінің құрамына (дәстүрлі N-соңында) жетекші немесе сигналды бір ізді қатар (бастауыш) деп аталатын құрылым кіреді. Бұл құрылым – гидрофобты радикалдармен көрінеді де эндоплазматикалық ретикулум (ЭПР) цистерналар ішінде мембрананың липидті қабаты арқылы рибосомадан осы молекуланың өтуін қамтамасыз етеді. Мембрана арқылы молекула өткен кезде шектеулі протеолиз нәтижесінен жетекші (бастауыш) бір ізді қатар ажыратылады да ЭПР ішінде бастауыш гормон қалады. Кейін ЭПР жүйесі арқылы бастауыш гормон Гольджи комплексіне тасымалданып жетілген формасына ауысады. Қайтара гидролиз қорытындысынан спецификалы протеиназалар әсерінен қалған (N-соңы) фрагмент кесіледі (алғашқы бөлім). Спецификалық биологиялық активті түзілген гормон молекуласы секреторлы көпіршіктерге түседі де бездің секреция уақытына дейін жинақталынады.
Ұйқы безде инсулин синтезі келесі жолмен өтеді. Лангерганс клеткаларының рибосома ЭПР преинсулин деген бастауыш пептиді синтезделінеді. Ол 110 амин қышқылды қалдықтардан құралған полипептидті тізбегі және бір ізділікпен орналасқан: Сп-пептид, А-пептид, C-пептид және В-пептид. ЭПР синтезінен кейін бірден осы молекуладан сигнальды (Сп) пептиді – 24 амин қышқылды қатары ажыратылады, ЭПР гидрофобты липидті мембранадан синтезделген молекула өтуіне қажет. Гольджи комплексіне тасымалданатын проинсулин пайда болады, онда жартылай протеолиз жүреді – проинсулин молекуласынан А және В тізбегін қосатын 31 амин қышқылды фрагменті – С-пептидін арнайы эндопептидаза көмегімен кесіліп алынады. Секреторлы гранулаларда инсулин цинк иондарымен қосылып кристалды гексамерлі агрегат түзеді. 51 амин қышқылды қалдықтары бар осындай нәруыз дисульфидті көпірмен байланысқан екі А және В полипептидті тізбектерден құралған (сурет ). Сонымен, Лангерганс клеткаларынан процессинг нәтижесінен препроинсулиннен проинсулин және кейін инсулин пайда болады:
а) - препроинсулин /-------/ /-------/ /--------/ /-- -----/ ,
Сп А С В
Онда Сп – бұл сигналды пептид, нәруыздың экспрессиясына қажет, С – дәнекерлік пептид, дисульфидті байланыстар біріккенде А және В тізбектердің қажетті ориентациясын қамтамасыз етеді, А – 21 аминқышқылды қалдықтардан құралған тізбек, В – 30 аминқышқылды қалдықтан тұратын тізбек;
б) - проинсулин /--------/ /-------/ /--------/, Сп жоқ;
А С В
в) - инсулин А ------------------ СООН
s s
s s
NH--------------------B, Сп және С жоқ.
Сурет . Инсулин процессингінің сатылары (а, б, в)
Дегенмен, ірі қара малдың инсулині адамдікінен үш амин қышқылды қатармен ажыратылады, шошқанікі – біреу, сондықтан науқас организмінде осындай пептидтерге қарсы антиденелер түзілуі мүмкін.
Қазіргі уақытта гендік-инженерлік технологиясы, бактериялардың (E. coli), ашытқылардың (Saccharomyces cerevisiae) және т.б. рекомбинантты штамдар көмегімен алынған адамның инсулин препараттары қолданылады.
Алғашында А және В тізбектердің синтезі, E.coli рекомбинантты штамдардың бір клеткасында сигналды және дәнекерлік пептидтер синтезі технологиясы өнделді (сур.30). Сонымен қатар, адам инсулині генін клондау және экспрессиялау барысында прокариоттарда препроинсулин түзілді (бактериялық клеткаларда процессингі жоқ), ал олардың активтілігі болмайды. Әрі қарай препроинсулиннен көп сатыларда қажетті ферментпен өндеп инсулин алуға болады, бірақ бұл өте күрделі және қаражатты биохимиялық процесс болып келеді.
Ұйқы безі RNA бөліп алу препроинсулиннің mRNA керісінші транскриптаза
препроинсулин геннің DNA плазмидаға генді енгізу рекомбинантты DNA
бактерия клеткасына плазмиданы енгізу рекомбинантты клетка бактерияның кобейюі
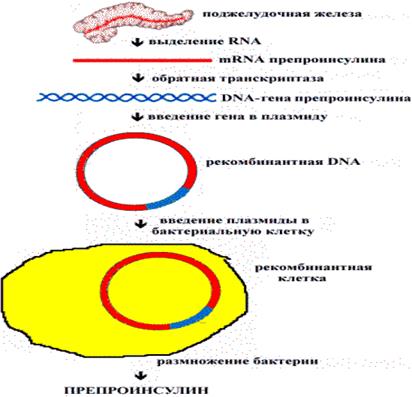
Сурет 30. Прокариот клеткасында препроинсулин синтезінің сызбанұсқасы
Осы себептен E.coli клеткасынан гендік-инженерлік инсулин алу технологиясы мүлдем өзгертілді. Алдымен химиялық жолмен А-тізбекті және В-тізбекті кодтайтын кДНҚ – екі нуклеотидті қатарлар бөлек синтезделінеді. Әрі қарай оларды бөлек екі векторлы плазмидаға енгізеді, соңғылары екі әртүрлі E. сoli штамдарын трансформациялайды. Осындай кДНҚ фрагменттерде сигнальды (Сп) және дәнекерлік (С) пептидтерді кодтайтын нуклеотидті қатары жоқ. Гендік модификацияланған E. coli бөлек дақылдандырады, кейін дақылдық ортадан инсулиннің рекомбинантты нәруыздарын - А және В тізбектерін бөліп алады, оларды химиялық реакцияда дисульфидті байланыспен біріктіреді, таза биологиялық активтілігі жоғары инсулин алынады.

Сурет 31. ASM-800 ДНҚ синтезаторы
Инсулиннің А және В тізбегін кодтайтын ДНҚ қысқа фрагменттерін, бір тізбекті олигонуклеотидтерді ДНҚ-синтезаторы көмегімен химиялық синтезде алуға болады (сур. 31). Бұл препарат клапандар мен насостар жүйесінен құралған, нақты белгілі бағдарлама бойынша реакциялық қоспаға нуклеотидтер мен реагенттерді енгізеді, нәтижесінде өсіп бара жатқан нуклеотидтер тізбегіне қажетті мономерлі бірліктерді қосуын қамтамасыз етеді. Биологиялыққа қарағанда ДНҚ-ның химиялық синтезі барысында тізбектің 5-штрих гидроксильді соңына әрбір жаңа нуклеотидті біріктіруге (қосуға) болады. Осындай барлық реакциялар компьютерлік бағдарламалармен жабдықталған бір реакциялық колонкада бір ізділікпен өтеді.
Рекомбинантты инсулин алу технологиясы келесі сатылардан өтеді:
- А және В тізбектерді кодтайтын ДНҚ-ның химиялық синтезі;
- осындай нуклеотидтер қатары E.coli-діңбета-галактозидаза ферментінің жарты молекуласын кодтайтын lacZ геніне ендіріледі, lacZ ген pBR322 плазмида құрамында кездеседі;
- әр бір lacZ геномы және А (немесе В) тізбегі бар плазмиданы E. сoli бөлек штамдарына ендіреді;
- өндіруші штамдарды екі бөлек биореакторларда дақылдандырады – трансформацияланған E. coli ковалентті байланысқан рекомбинантты нәруыздар молекуласын (А немесе В-тізбектері) түзетін химерлі нәруыздар мен эшерихийлердің өзіндік нәруыздары;
- бөліп алынған химерлі нәруыздарды метионин қалдығы бойынша нәруыздарды ажырататын бромцианмен өндейді. Әрі қарай А және В тізбектері бета-галактозидаза фермент нәруызынан ажыратылады да тазартылады;
- тазартылған А және В тізбектерін дисульфидті байланыспен қосады, инсулиннің екі тізбекті биологиялық активті мономері алынады.
Дата добавления: 2015-07-14; просмотров: 6251;
