Полярность
Обуславливается различной электроотрицательностью соединя-ющихся атомов.
Величина электроотрицательности Х вычисляется как полусумма энергии сродства к электрону (энергии, выделяющейся при присоединении электрона к атому) и энергии ионизации (энергии, которая затрачивается для отрыва электрона от атома).
Х = ½ (Е + I)
Электроотрицательность характеризует способность атома притягивать к себе электронное облако связи. По шкале Полинга относительная величина электроотрицатеьности уменьшается в ряду:
| F | O | N | C | H | эл.вольт/ г-экв. |
| 4,0 | 3,5 | 3,0 | 2,5 | 2,1 |
Если разница в электроотрицательности 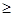 1,7, то общая электронная пара целиком переходит к более электроотрицательному атому и образуется ионная связь. При разнице <1,7 образуется связь ковалентная полярная.
1,7, то общая электронная пара целиком переходит к более электроотрицательному атому и образуется ионная связь. При разнице <1,7 образуется связь ковалентная полярная.
Область максимальной электронной плотности смещена к более электроотрицательному атому.
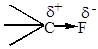
Если атомы имеют одинаковую электроотрицательность, и две части молекулы симметричны, то связь неполярная: СН3-СН3. Полярность связи может быть охарактеризована величиной дипольного момента связи, который можно рассматривать как произведение расстояния между центрами тяжести положительного и отрицательного заряда l на абсолютную величину сосредоточенного в этих центрах заряда е.
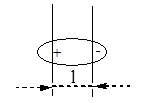
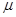 = l . e
= l . e
Полярность кратных связей в несколько раз выше, чем простых, т.к. p-электроны очень подвижны и смещаются сильнее, чем s-электроны. Из всех ковалентных связей наиболее полярными являются координационные.
Дата добавления: 2015-08-21; просмотров: 955;
