ЭЛЕКТРОННЫЕ ПРЕДСТАВЛЕНИЯ О ПРИРОДЕ ХИМИЧЕСКОЙ СВЯЗИ
В органических соединениях преобладающим типом связи является ковалентная связь, образующаяся чаще всего между атомами, имеющими неспаренные электроны. Количество неспаренных электронов у атома можно определить, используя понятия квантовой химии. Электрон обладает двойственной природой: он может проявлять свойства частицы и свойства волны. При движении вокруг ядра атома каждый электрон создает электронное облако, определенным образом распределенное в пространстве. Пространство, занимаемое электронным облаком, называется атомной орбиталью. Каждое устойчивое положение электрона определяется четырьмя квантовыми числами:
1. Главное квантовое число n- показывает уровень энергии электронов, который определяется расстоянием электрона от ядра;
2. Побочное (орбитальное) квантовое число l характеризуется моментом количества движения электрона относительно ядра и определяет форму атомной орбитали. В зависимости от числа l, принимающего значения до n-1, то есть 0,1,2,3, различают s, p, d, f-подуровни. Для s-подуровня (L=0) электронное облако имеет сферическую форму, для р-подуровня (L=1) – форму гантелей, d и f-орбитали (L=2, 3) имеют похожую, но более сложную форму.
3. Магнитное квантовое число ml характеризует ориентацию орбитали по отношению к внешнему магнитному полю.S-орбиталь имеет центр симметрии и может иметь только одну ориентацию.
Р-орбиталь имеет ось симметрии, может располагаться в трех взаимно перпендикулярных плоскостях.
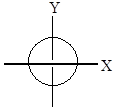
| 
|
| s-орбиталь | p-орбиталь |
Рисунок 1
4. Спиновое квантовое число ms характеризуется моментом количества вращения электрона вокруг собственной оси. Так как электрон может вращаться только в двух направлениях – по и против часовой стрелки, спин имеет два значения. В одной орбитали могут размещаться два электрона с противоположными спинами.
Если атомная орбиталь содержит один (неспаренный) электрон, такое состояние неустойчиво, так как у атома имеется нескомпенсированный магнитный (спиновый) момент и он стремится обобщить свой неспаренный электрон с неспаренным электроном другого атома.
Количество неспаренных электронов может увеличиваться в результате возбуждения атома. Возбуждение возможно при получении кванта энергии и при наличии незаполненной орбитали на внешнем энергетическом подуровне, при этом один из спаренных электронов переходит на ближайший подуровень, например, с s-подуровня на р-подуровень или с р-подуровня на d-подуровень. Углерод имеет 6 электронов со следующим их распределением по энергетичесским уровням и подуровням:

|

Дата добавления: 2015-08-21; просмотров: 839;
