Окисление. Для спиртов характерны реакции горения с образованием углекислого газа и воды, а также реакции окисления
Для спиртов характерны реакции горения с образованием углекислого газа и воды, а также реакции окисления, приводящие к получению альдегидов, кетонов и карбоновых кислот. В лабораторных условиях для окисления спиртов обычно используют подкисленные растворы перманганата или дихромата калия, оксид меди и т.д.
При окислении первичных спиртов сначала образуются альдегиды, которые, в свою очередь, могут окислиться до карбоновых кислот:
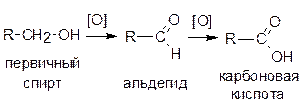
Вторичные спирты окисляются до кетонов:
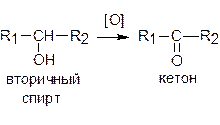
Третичные спирты могут окисляться только с разрывом связей углерод-углерод.
Приведем примеры реакций. Окисление этанола K2Cr2O7 или KMnO4 приводит к образованию этаналя:
3С2H5OH + K2Cr2O7 + 4H2SO4 =
3CH3CHO + 2Cr2(SO4)3 + K2SO4 + 7H2O.
Если образовавшийся альдегид не выделить сразу из реакционной смеси, то он будет окисляться дальше, и конечным продуктом реакции будет этановая (уксусная) кислота:
3С2H5OH + 2K2Cr2O7 + 8H2SO4 =
3CH3COOH + 2Cr2(SO4)3 + 2K2SO4 + 11H2O.
В качестве окислителя можно использовать нагретый оксид меди (II):
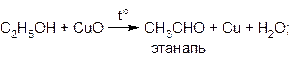
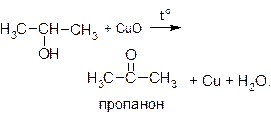
Для проведения этой реакции обычно из медной проволоки делают спираль, нагревают ее до образования на поверхности черного налета CuO и, не давая остыть, опускают в спирт. Появляется характерный запах альдегида, черный налет исчезает, и проволока снова приобретает характерный для меди розово-красный цвет. Эту реакцию можно считать качественной пробой на спирты.
Превращение спиртов в альдегиды можно осуществить и путем дегидрирования, протекающего при пропускании паров спиртов над нагретым металлическим катализатором, например, медью:
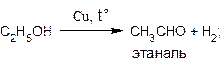
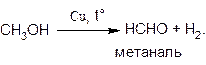
С формальной точки зрения эти реакции также можно отнести к реакциям окисления спиртов.
Дата добавления: 2015-08-21; просмотров: 1245;
