СТРОЕНИЕ МОЛЕКУЛЫ БЕНЗОЛА. АРОМАТИЧНОСТЬ
Раздаточный материал к лекции 5






С.В.Стаханова
Лекция 5
АРОМАТИЧЕСКИЕ УГЛЕВОДОРОДЫ
КЛЮЧЕВЫЕ СЛОВА: ароматические углеводороды, арены, sp2-гибридизация, единое p-электронная облако, круговое сопряжение, ионный механизм реакции замещения, электрофильное замещение, нитрование, галогенирование, алкилирование по Фриделю-Крафтсу, алкилирование алкенами, гидрирование, окисление.
СТРОЕНИЕ МОЛЕКУЛЫ БЕНЗОЛА. АРОМАТИЧНОСТЬ
Ароматические углеводороды (арены) – это углеводороды, молекулы которых содержат одно или несколько бензольных колец.
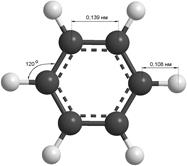
Простейшим представителем ароматических углеводородов является бензол, молекулярная формула которого С6Н6. Установлено, что все атомы углерода в молекуле бензола лежат в одной плоскости, образуя правильный шестиугольник (рис. 1). Каждый атом углерода связан с одним атомом водорода. Длины всех связей углерод-углерод одинаковы и составляют 0,139 нм.
 а а
|  б б
|
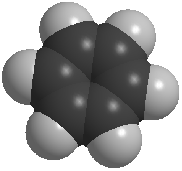
Рис. 1. Модели молекулы бензола: а) шаростержневая; в) полусферическая.
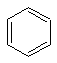
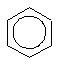
Для изображения молекулы бензола пользуются следующими структурными формулами:
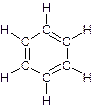
| 
| 
|
| а | б | в. |
Формулы а) и б) предложил в 1865 г немецкий химик Август Кекуле. Несмотря на то, что они недостаточно точно передают строение молекулы бензола, их используют до сих пор и называют формулами Кекуле.
Исторически название «ароматические углеводороды» сложилось потому, что многие производные бензола, которые первыми были выделены из природных источников, обладали приятным запахом.
В настоящее время под понятием «ароматичность» подразумевают, прежде всего, особый характер реакционной способности веществ, обусловленный, в свою очередь, особенностями строения молекул этих соединений.
В чем же состоят эти особенности?
В соответствии с молекулярной формулой С6Н6 бензол является ненасыщенным соединением, и можно ожидать, что для него были бы характерны типичные для алкенов реакции присоединения. Однако в условиях, в которых алкены быстро вступают в реакции присоединения, бензол не реагирует или реагирует медленно. Бензол не дает и характерных качественных реакций, свойственных непредельным углеводородам:онне обесцвечивает бромную воду и водный раствор перманганата калия.
Такой характер реакционной способности объясняется наличием в ароматическом кольце сопряженной системы – единого p-электронного облака.
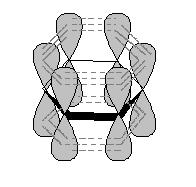
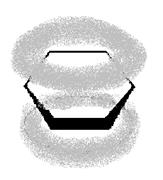
В молекуле бензола каждый атом углерода находится в состоянии sp2-гибридизации и связан тремя s-связями с двумя атомами углерода и одним атомом водорода. Четвертый валентный электрон атома углерода находится на p-орбитали, перпендикулярной плоскости молекулы. В молекуле бензола происходит боковое перекрывание р-орбиталей каждого атома углерода с р-орбиталями обоих соседних атомов углерода (рис. 2). В результате такого сопряжения образуется единое p-электронное облако, расположенное над и под плоскостью бензольного кольца – осуществляется круговое сопряжение.
Такая циклическая система с общим облаком из шести электронов очень устойчива, энергетически выгодна; поэтому бензол преимущественно вступает в те реакции, в которых ароматическое кольцо сохраняется.
 а а
|  б б
|
Рис. 2. Электронное строение молекулы бензола: а) схема перекрывания р-орбиталей; б) единое p-электронное облако.
Подчеркнем еще раз, что в молекуле бензола нельзя выделить трех двойных и трех простых связей. Электронная плотность распределяется в молекуле равномерно, и все связи между атомами углерода оказываются совершенно одинаковыми. Поэтому нужно помнить, что формула Кекуле, которая часто используется для изображения бензола, условна и не отражает реального строения его молекулы.
Итак, ароматическимиявляются соединения, в молекулах которых имеется устойчивая циклическая группировка с особым характером связи. Имея молекулярную формулу, указывающую на высокую степень ненасыщенности, эти вещества, однако, не реагируют как ненасыщенные, а вступают преимущественно в реакции замещения с сохранением ароматической системы.
ГОМОЛОГИ БЕНЗОЛА,
Дата добавления: 2015-08-21; просмотров: 3620;
