Технологическая схема синтеза аммиака.
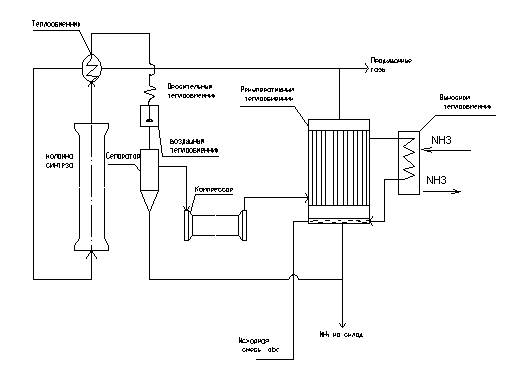
Реакция (1.1) DH< 0 (экзотермическая реакция) осуществляется в колонне синтеза (Р=30 МПа, Т=6000С).
Исходная азотоводородная смесь (abc) проходит рекуперативный теплообменник (движение в трубном пространстве), нагреваясь за счет тепла, подаваемого в циркулирующую abc (движение в межтрубном пространстве) и поступает в колонну синтеза. Реакционная смесь (РС) из колонны синтеза (содержание не более 15 % NH3) проходит через систему теплообменников, охлаждается и NH3 конденсируется. В сепараторе сконденсированный NH3 отделяется от непрореагирующей азотно-водородной смеси. Не прореагировавшаяся abc компрессором дожимается до рабочего давления и возвращается в цикл.
 : рекуперативный теплообменник, система теплообменников
: рекуперативный теплообменник, система теплообменников

: колонна синтеза
 - это устройство, предназначенное для осуществления химических реакций, сопровождаемых гидродинамическими, тепло – и массообменными процессами.
- это устройство, предназначенное для осуществления химических реакций, сопровождаемых гидродинамическими, тепло – и массообменными процессами.

: сепаратор
- совокупность аппаратов (устройств), предназначенных для выделения ЦП
Рис.2.2 Схема колонны синтеза:
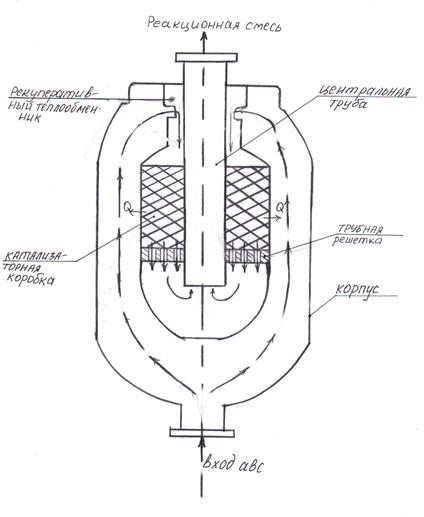
Исходная abc поступает в нижнюю часть колонны синтеза, проходит снизу вверх по каналу коаксиальнообразованному внутренней боковой поверхностью корпуса и наружной боковой поверхностью катализаторной коробки, нагревается за счет Q, отходящей из зоны реакции. Затем проходит через рекуперативный теплообменник, поток смеси изменяет направление на 1800 и поступает потом на верхний слой катализатора (твердые частицы оксида железа: FeO, Fe2O3. На поверхности катализатора протекает реакция (1.1). реакциооная смесь выходит из катализаторной коробки, поднимается по центральной трубе и выходит из колонны синтеза.
Технологические критерии:
1.Степень превращения хj (степень использования сырья)
Характеризует долю прореагирующего исходного реагента.
 aA+bB rR+sS (2.1)
aA+bB rR+sS (2.1)
A и B – исходные реагенты,
R и S – продукты реагенты,
a, b,r,s - стехиометрические коэффициенты.
Уравнение химической реакции записывается на основе закона сохранения массы.
j – исходный реагент.
хj степень превращения для продуктов реакции (ПР) не существует.
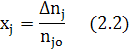
∆ nj= nj,0 −nj,f (2.3)
где nj,0 и nj,f - начальное количество исходного реагента (ИР) и количество не прореагирующего исходного реагента (на выходе из реактора или к определенному моменту τ) в [молях или киломолях], если рассматривается газофазная реакция и не учитывается изменение объема в процессе протекания реакции, то степень превращения хj(nj) или хj(сj).
nj [кмоль ]
сj [кмоль/м3]
с – массовая доля (%)
масс % - количество вещества в 100 граммах смеси.
Объемная доля (%) – количество вещества в общем объеме смеси.
N нормальное количество грамм-эквивалент в единице объема.
Мольная: 
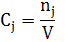
V- объем, занимаемый реакционной смесью.
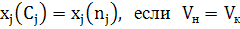
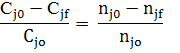
Если при протекании реакции изменением объема можно пренебречь, тогда хj(nj) = хj(сj) по величине ∆N=(r+s+…) – (a+b+…)
Если ∆N>0, то реакция идет с увеличением объема.
Если ∆N<0, то реакция идет с уменьшением объема.
Для реакции (1.1):
∆N=2-(3+1) <0
∆N=0, отсюда следует хj(nj) = хj(сj).
хj – это безразмерная величина, изменяется от 0 до 1.
Примеры расчета:
Пример (2.1): В реакторе синтеза аммиака осуществляется реакция (1.1), причем nН2,O=5 кмоль, xsH2=0.15 (на выходе из реактора).Требуется определить количество водорода nrH2,f в реакционной смеси на выходе из реактора.
Расчеты по уравнению химической реакции осуществляются на основе системы стехиометрических соотношений (ССС).
Для реакции (2.1) ССС:
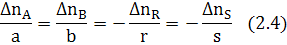
ССС показывает в каких пропорциях вещества вступают в реакцию и образуются.
Для примера (2.1):
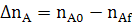 ;
; 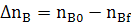 ;
;
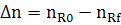 ;
; 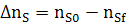 ;
;
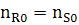 =0
=0
Предусматривается, где рассматриваются процессы без рециркуляции реакционной смеси.
Запишем ССС (2.4) через степень превращения, для этого разделим и умножим соответствующие дроби, записанные для исходных реагентов на соответствующее значение начального количества вещества.
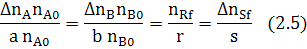
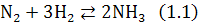
A B R
Для реакции (1.1) запишем ССС:
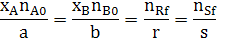
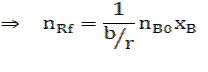
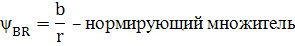
Подставим в (2.6) исходные данные примера (2.1) получим:
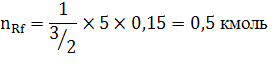
Проанализируем пути увеличения nr,f , т.е. продукта реакции:
Смотри формулу (2.6)
- повышение nB,0 в исходной смеси abc выше стехиометрического значения.
- Экономические затраты на получение Н2
- 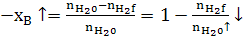
- повышение хB H2 степени превращения
- xj,e –равновесная степень превращения(только для исходной реагентов).
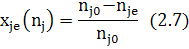
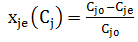 (2.7')
(2.7')
xj,e – равновесная степень превращения (записывается только для исходных реагентов), характеризует долю прореагирующего исходного реагента к моменту равновесия.
Химическое равновесие – это динамическое равновесие, характеризующееся равенством скоростей прямой и обратной реакции в момент равновесия общая скорость процесса.
Лекция 3.
Дата добавления: 2015-08-21; просмотров: 1460;
