Quot;пр
Значения величины изменения энтропии AS° при изменении температуры также изменяются. Уравнение для расчета значений изменения энтропии при изменении температуры имеет
вид
Т ДСР Л5° = S —zr dT.
о На практике зачастую температурные условия по ходу процесса существенно меняются. Это необходимо учитывать, чтобы дать тому или иному процессу точную количественную
оценку.
Чаще всего используют формулу
AG = AH- TAS, где ДЯ и AS близки к средним значениям ДЯ и AS для данного интервала температур. В таблицах значения приводят обычно в виде AG = А + ВТ.
При изменении температуры изменяются и ДЯ и AS, но AS изменяется в большей мере, в результате оказывается, что AG < 0; при равновесии AG = 0, поэтому величина AG, если реакция написана в направлении ее протекания, всегда получается с минусом. Если в результате расчета величина AG
 получается с плюсом, то реакция (процесс) идет в обратном направлении. Процесс или реакция могут идти самопроизвольно лишь в том случае, когда энергия Гиббса системы уменьшается.
получается с плюсом, то реакция (процесс) идет в обратном направлении. Процесс или реакция могут идти самопроизвольно лишь в том случае, когда энергия Гиббса системы уменьшается.
Изменение энергии Гиббса используют для определения меры химического сродства веществ. Константа равновесия Кр характеризует степень протекания реакции в ту или иную сторону. Поскольку ДО° = Д#°-ТД50 и AG° * -RTln Кр, то -RTla Кр = ДЯ° - ГД5Я, откуда R In Кр = Д5°-ДЯ°/Г. Отсюда видно, что чем больше величина AS° и чем Меньше ЬН°/Т, тем полнее идет реакция. Из уравнения видно также, что чем выше температура, тем большее значение имеет величина Д5° (энтропийный фактор) и меньшее LH°/T (энтальпийный фактор). При производстве стали протекают процессы окисления железа и его примесей (углерода, кремния, марганца) и образования соответствующих оксидов (СО, SiOj, MnO). Способность железа и его примесей окисляться, т.е. химическое сродство к кислороду, часто выражают при помощи давления диссоциации оксидов. Давление диссоциации* в
данном случае представляет собой давление кислорода р
Ог
при равновесии системы кислород—оксид: Ме + 02 = Ме02;Кр = аШе0у(аш.Ро).
В случае чистых металла и оксида а = 1 и а =
(МеОг) Me
= 1, а тогда
Кр = 1/р и bG° = RT In p .
Таким образом давление диссоциации является мерой прочности оксида: чем меньше эта величина, тем прочней оксид.
В сталеплавильной ванне участвующие в реакциях компоненты находятся в виде раствора в металле (железе) и шлаке.Вещество, переходя в раствор, становясь компонентом раствора, теряет свою индивидуальность. Значения термодинамических функций для процессов, реакций, происходящих между веществами, находящимися в растворе, существенно отличаются.
« Прежнее название — упругость диссоциации.
Обычно в качестве стандартного состояния выбирают либо чистое вещество, либо однопроцентный раствор этого вещества.
Если р — давление пара компонента, находящегося в растворе, а р° — давление пара компонента в стандартном состоянии, то отношение р/р° принято называть активностью данного компонента и обозначать а, т.е. р/р° = а. Активность вещества в стандартном состоянии принимают равной единице.
Для термодинамических расчетов активность представляет собой вспомогательную расчетную величину, которая «характеризует степень связанности молекул, атомов или ионов исследуемого компонента. При образовании данным компонентом в растворе каких-либо соединений его активность понижается, и, Наоборот, активность возрастает при уменьшении сил взаимодействия между частицами растворителя и растворенного вещества.
Большинство компонентов, встречающихся в металлургической практике, образует в железе растворы, далекие от идеальных. Соотношения между составом и свойствами большинства реальных растворов очень сложны и не всегда ясны. Положение облегчается тем, что обычно мы имеем дело с растворами в железе небольших количеств (часто < 1 %) других компонентов. При уменьшении концентрации растворенного вещества свойства реального раствора приближаются к свойствам идеального. Такие растворы принято называть бесконечно разбавленными или разбавленными. В этих случаях принято использовать закон Генри, согласно которому в разбавленном растворе давление пара растворенного вещества Pi прямо пропорционально его концентрации ch т.е. pj-rcj, где г — коэффициент (константа Генри). Обычно реальные растворы подчиняются закону Генри при изменении концентрации в интервале от долей процента до нескольких процентов.
В достаточно сильно разбавленном растворе можно принять активность- равной концентрации: aj = Cj или aj = Xj. При повышении концентрации растворенного компонента приходится вводить вспомогательную величину yj = aj/xj, соответственно at■, = "gjXj. Величина у h называемая коэффициентом активности, характеризует степень отклонения свойств рассматриваемого компонента в данном растворе от
 его свойств в идеальном растворе. Для идеальных растворов 7 = 1. К таким растворам близки растворы никеля, кобальта, марганца, хрома в железе.
его свойств в идеальном растворе. Для идеальных растворов 7 = 1. К таким растворам близки растворы никеля, кобальта, марганца, хрома в железе.
Для обозначения коэффициентов активности обычно используют буквы г или /. Буквой у обозначают коэффициент активности при использовании соотношения aj = jjXj, т.е. тогда, когда концентрация выражается в мольных долях (компонента /). Если массовая концентрация выражается в процентах, то для обозначения чаще используют букву /. В реальных условиях на величину коэффициента активности компонента в растворе влияет взаимодействие растворенных в металле других компонентов. В тех случаях, когда компонент растворен в металле, принято! использовать квадратные скобки, например [С], [Mn], [Si] и т.д. В случаях, когда речь идет о концентрации того или иного компонента в шлаке, используют круглые скобки: (FeO), (MnO), (СаО) и т.д.
Таким образом, если написано [Mn] + (FeO) = (MnO) + + Fex, то это означает, что реакция происходит между растворенным в металле (железе) марганцем и растворенной в шлаке закисью железа. Константа равновесия этой реакции может быть записана следующим образом:
^М„= *(МпО) или ^М„= У(МП0)(МП0)
Vn]a(FeO) yMn[Mnl3f(FC0)Fe°
„М„ '(MnO)(Mn0)
или К =--------------
WMn]''(FeO)(Fe0)'
2. Кинетика сталеплавильных процессов
Если термодинамика позволяет получать ответы на вопросы о том, каково направление протекания процесса, какое количество энергии при этом выделяется (поглощается), какова характеристика последней стадии процесса, каково соотношение концентраций (активностей), при которых наступает состояние равновесия, то кинетика позволяет ответить на вопрос о том, какова скорость процесса, ее зависимость от отдельных параметров.
В общем случае протекание реакции в сталеплавильной ванне может быть представлено в следующей последовательности:
а) подвод реагентов к месту реакции;
б) акт химической реакции;
в) выделение продуктов реакции в отдельную фазу и их
удаление.
В каждом конкретном случае одно из этих звеньев может лимитировать протекание процесса в целом, если скорость данного звена процесса будет меньше, чем двух других. Для большинства металлургических реакций при температурах сталеварения сам акт химической реакции протекает практически мгновенно и не лимитирует протекание процесса вце-лом. Скорость процесса в целом в значительном числе случаев определяется скоростью подвода реагентов к месту реакции (например, интенсивностью подачи кислорода при продувке металла в конвертерном процессе или интенсивностью диффузии примесей металла к границе металл—шлак и т.п.).
В некоторых случаях, когда в результате реакции должна образоваться новая фаза (например, образование пузырька газа внутри стальной ванны, образование неметаллического включения, образование твердого кристаллика металла при кристаллизации стали), скорость процесса в целом может быть лимитирована скоростью процесса зарождения и выделения новой фазы.
Это связано с тем, что в обычных условиях зародыши любой новой фазы становятся устойчивыми лишь при достижении определенных (критических) размеров. Рост зародыша до этих размеров приводит к увеличению свободной энергии системы. Этот начальный рост свободной энергии вызван затратой работы (энергии) на создание поверхности раздела между зародышем новой фазы и исходной фазой. Буквенным символом величины энергии, затрачиваемой на образование единицы поверхности (называемой поверхностным натяжением), обычно служит сг, а обозначение ее является Дж/м2 (энергия на единицу поверхности) или Н/с (сила на единицу длины). Обычно термин "поверхностное натяжение" применяют при рассмотрении свойств тела на границе с газовой фазой, т.е. в тех случаях, когда можно пренебречь поверхностным натяжением второй фазы. Для случая поверхности раздела жидкость—жидкость (например, металл—шлак) применяют термин "межфазное натяжение". Процессы, связанные с уменьшением энергии системы, протекают самопроизвольно. Соответственно и процессы, связанные с уменьшением величины по-

 верхностного натяжения, также будут протекать самопроизвольно. При этом в поверхностном слое будет повышаться концентрация того из компонентов, прибавление которого понижает поверхностное натяжение (явление адсорбции). Вещества, снижающие поверхностное натяжение растворителя, т.е. вещества, концентрация которых в поверхностном слое выше, чем в растворителе, называют поверхностно-активными веществами. Исследования показали, что такие элементы, как кислород, сера, бор, церий, кальций и ряд других в растворе жидкого железа, являются поверхностно-активными (рис. 73). Величина поверхностного натяжения чистого железа с составляет примерно 1,8 мДж/м2. Небольшие добавки поверхностно-активных элементов снижают величину а
верхностного натяжения, также будут протекать самопроизвольно. При этом в поверхностном слое будет повышаться концентрация того из компонентов, прибавление которого понижает поверхностное натяжение (явление адсорбции). Вещества, снижающие поверхностное натяжение растворителя, т.е. вещества, концентрация которых в поверхностном слое выше, чем в растворителе, называют поверхностно-активными веществами. Исследования показали, что такие элементы, как кислород, сера, бор, церий, кальций и ряд других в растворе жидкого железа, являются поверхностно-активными (рис. 73). Величина поверхностного натяжения чистого железа с составляет примерно 1,8 мДж/м2. Небольшие добавки поверхностно-активных элементов снижают величину а
на 20—30 %, при этом соответственно увеличивается адсорбция этих элементов в поверхностном слое (например, на границе металл—шлак, металл—под, жидкий металл—растущий кристалл при застывании металла). Особенность поверхностных явлений заключается в том, что при их наличии проявляется действие ничтожных концентраций примесей (такие же концентрации примесей, но равномерно распределенные в объеме вещества, не могут оказать существенного влияния на объемные свойства).
Роль поверхностных явлений в металлургических процессах чрезвычайно велика. Большинство металлургических процессов основано на гетерогенных реакциях, связанных с исчезновением одних и появлением других фаз; сами реакции во многих случаях протекают на границе раздела фаз. Поэтому приходится учитывать, что и свойства, и составы пограничных слоев отличаются от объемных свойств.
 N
N
X/бОО •шо\-
| 800 |
| 0,2 Ofi |
ъ
| 0,6 |
| О.П |
0,8 0,02 0,06 0,10 СО],'/.
Рис. 73. Влияние серы и кислорода на поверхностное натяжение жидкого железа 214
При образовании новой фазы сначала в результате флуктуации должны образоваться термодинамически устойчивые зародыши новой фазы. Вероятность флуктуации определяется работой, необходимой для ее осуществления, а эта работа связана с большей удельной поверхностью зародыша и поэтому зависит от величины поверхностного натяжения на границе зародыш—среда. Чем меньше поверхностное натяжение, тем меньшая работа требуется для образования зародыша, тем благоприятнее условия для образования (выделения) новой фазы. Следовательно, наличие в металле поверхностно-активных примесей облегчает условия выделения (образования) новой фазы, например образования в металле пузырьков газа, неметаллических включений, кристаллов). Эти же поверхностно-активные вещества, адсорбируясь на растущей фазе, могут затормозить ее рост. На этом свойстве поверхностно-активных примесей основаны, например, способы модифицирования чугуна и стали. Небольшая добавка такого элемента, как бор, позволяет получать мелкозернистую структуру металла.
Выше уже отмечалось, что в металлургии многие процессы протекают на границе раздела фаз. В связи с этим при решении многих практических задач приходится учитывать также различную степень смачиваемости между различными фазами. Практика показывает, что разделение отдельных фаз (например, отделение шлака от металла) встречает определенные трудности, так как почти всегда на границе раздела происходит взаимное притяжение фаз. Это явление называют адгезией. Работа, которую необходимо затратить для разделения двух фаз (обычно рассматривают случай, когда площадь контакта равна 1 м2 или 1 см2), называют работой адгезии.
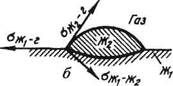
Если жидкая фаза (например, шлак) соприкасается с твердой (например, огнеупором), то капля шлака, расплавленная на поверхности огнеупора (рис. 74), испытывает одновременно воздействие трех величин: сш-г, ^ш-огн и
^огн-г-
Силы поверхностного натяжения стремятся уменьшить поверхности контактирующих фаз. В результате наступает равновесие трех сил:
°огн-г.= аш-огн + tfui-rcos е-
 |  |
|
°ш-огн \ Огнеупор
Рис. 74. Схема образования капли шлака на твердой поверхности (я) и на поверхности жидкого металла (б): 2Kj — металл; Ж2 — шлак
| в"90' |
| в'О |
| в |
в'ТвО* в>90'
>mvww)/////w///Ј/s/;w///}/s
Рис. 75. Межфазное натяжение и смачиваемость
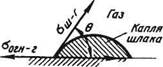
Угол 0 называют краевым углом смачивания. Величина угла 0 определяется соотношением
cos 0 = (tfor-н-г - 0"ш-огн)/°'ш-г или в общем случае
COS 0 = (о-тв_г - Сж-тв)/(Уж-г-
В зависимости от природы контактирующих фаз угол смачивания изменяется от 180 до 0°. При 0 = 180° имеет место случай полного несмачивания. На практике почти всегда происходит частичное смачивание (рис. 75) и величина угла 0 колеблется в широких пределах. Знание степени смачивания и величины краевого угла смачивания помогает решать многие практические задачи. Если, например, известно, что при соприкосновении жидкого шлака определенного состава с футеровкой величина краевого угла смачивания невелика (0 < 90°), то этот шлак будет проникать в поры огнеупорного материала. Если же не желательно, чтобы происходило это проникновение, то необходимо подбирать такие составы шлаков (или огнеупоров), при которых величина краевого угла смачивания была бы большой (0 > 90°). Другой пример: если между металлом и находящимся в нем неметаллическим включением смачивание плохое, то это включение будет
быстрее отделяться от металла, чем в случае, когда смачивание между включением и металлом хорошее. Силы смачивания мешают полностью отделять шлак от металла. Кроме сил взаимного притяжения различных фаз на границе их раздела, необходимо учитывать силы взаимного притяжения внутренних слоев вещества. Явление взаимного притяжения внутренних слоев тела жидкости называют когезией. Если, например, взять столб металла сечением 1 м2 и разорвать (разделить) на два столба такого же сечения, то образуются две новые поверхности, каждая по 1 м2. На образование поверхности в 1м2 затрачивается энергия, численно равная величине поверхностного натяжения с (Дж/м2). Следовательно, в рассматриваемом примере будет затрачена энергия, равная 2о*. Явление когезии особенно приходится учитывать, когда по технологии необходимо раздроблять струю металла или шлака, в случаях образования трещин в застывающем слитке и в ряде других случаев.
3. Сталеплавильные шлаки
Выплавка стали обычно сопровождается процессами окисления железа и его примесей, а также процессами разъедания футеровки сталеплавильных агрегатов. В шихте, загружаемой в сталеплавильные агрегаты, всегда имееется большее или меньшее количество загрязнений. Кроме того, при ведении плавки в ванну обычно добавляют различные флюсы и добавочные материалы. В результате образуется неметаллическая фаза, называемая шлаком.
Источники образования шлака
Основные источники образования шлака следующие:
1. Продукты окисления примесей чугуна и лома — кремния, марганца, фосфора, серы, хрома и других элементов (Si02, MnO, Р205, FeS, MnS, Сг2Оэ и др.).
2. Продукты разрушения футеровки агрегата — при разъедании основной футеровки (доломита, магнезита) в шлак переходят CaO, MgO, при разъедании кислой (динас) — Si02.
3. Загрязнения, внесенные шихтой (песок, глина, мик-серный шлак и т.п.), - Si02, Al203, MnS и т.п.
4. Ржавчина, покрывающая заваливаемый в сталеплавильные агрегаты лом, — оксиды железа.

 5. Добавочные материалы и окислители (известняк, известь, боксит, плавиковый шпат, железная и марганцевая руды и т.п.) - CaO, A1203. Si02, FeO, FejQ3, MnO, CaF2 и т.п.
5. Добавочные материалы и окислители (известняк, известь, боксит, плавиковый шпат, железная и марганцевая руды и т.п.) - CaO, A1203. Si02, FeO, FejQ3, MnO, CaF2 и т.п.
В каждом конкретном случае степень влияния перечисленных загрязнений на состав шлаков различна. Вводя после соответствующего расчета то или иное количество определенных добавок, добиваются получения шлака нужного состава. При необходимости проводят операции обновления (скачивания) шлака, когда определенное количество шлака (иногда почти 100 %) удаляют из агрегата, а затем вводя нужное количество тех или иных добавок, "наводят" новый шлак необходимого состава.
Строение и составы шлаков
После отбора пробы шлака и проведения соответствующего анализа (состав шлаков устанавливают методами аналитической химии и спектрального анализа) сталевар получает данные (в %) о том, сколько в этой пробе шлака содержится CaO, Si02, Al203, FeO, MnO и других соединений. Приходится, однако, учитывать, что в лаборатории подвергают анализу шлак, уже застывший после отбора пробы из печи. В печи же (в агрегате) шлак находится в расплавленном состоянии. Жидкие расплавленные шлаки в металлургическом агрегате характеризуются наличием между составляющими шлака и ковалентной, и ионной связи. Образование ионов при расплавлении компонентов шлака можно представить следующими реакциями:
FeO -*■ Fe2+ + О2"; CaO —* Са2+ + О2";
MnO —* Мп2+ + О2"; MgO -r* Mg2+ + О2-;
(FeO)2 • Si02 —*■ 2Fe2+ + SiOf;
(MnO)2 • Si02 —» 2Mn2+ + SiO«~;
FeS —*Fe2+ + S2"; MnS ->Mn2+ + S2';
CaF2 —* Ca2+ + 2F~;
(CaO)3 • P2Os -*ЗСа2+ + 2РОГ и т.д.
Таким образом, сталеплавильные шлаки обычно имеют в своем составе такие катионы, как Fe2+, Mr.2+, Ca2+, Mg2+,
Сг2+, и такие анионы, как S2", О2-, SiO,-, AIO5-, POf, Fe02, FeO^", Si20$", CrOj и Т.п. Кроме того, в шлаке могут быть и сложные комплексы, близкие к составам таких соединений, как (СаО)4 • Si02; (FeO)2 • Si02; (CaO)4 • • P2Os. Поэтому данные, которые сталевар получает после анализа пробы шлака, далеко не полностью отражают истинную картину того, что находится непосредственно в печи.
Шлаки, в которых преобладают основные окислы (СаО, MgO, MnO, FeO), называют основными шлаками, а шлаки, в которых преобладают кислотные окислы (Si02, P205) — кислыми шлаками (рис. 76). В зависимости от характера шлаков и процессы называют основными или кислыми. Обычно и характер огнеупорных материалов, из которых сделана сталеплавильная ванна, соответствует характеру процесса (характеру шлака). Например, ванну печей, в которых осуществляют кислый мартеновский процесс, изготовляют из кислых огнеупорных материалов. Иначе шлак будет энергично взаимодействовать с огнеупорной футеровкой и разрушать ее (кислотные окислы активно взаимодействуют с основными). В тех случаях, когда в агрегате вообще нет футеровки (например, при электрошлаковом переплаве), состав шлака может быть любым.
Поскольку из всех перечисленных компонентов наибольшую долю в основных шлаках занимают СаО и Si02, отношение этих окислов CaO/Si02 характеризует степень основности (или просто "основность") основных шлаков. Шлаки, в которых отношение (CaO/Si02) < 1,5, называют низкоосновными; у шлаков средней основности CaO/Si02 = 1,6+2,5; у высокоосновных шлаков (CaO/Si02) > 2,5. При переделе фосфористых чугунов шлаки содержат много Р205. В этом случае для характеристики основности шлака используют величину отношения CaO/(Si02 + Р205).
|
1600
1500
\1Ш
1Ш
1200
10 J0 30 ML 50 60 ($10,),% Рис. 76. Температуры плавления шлаков
Кислые шлаки состоят главным образом из кислотного окисла Si02 и некоторого количества таких основных окислов, как FeO и МпО. Составы кислых шлаков характеризуются степенью их кислотности (или просто "кислотностью"), выражаемой обычно отношением Si02/(FeO + МпО).
Кроме основности шлака, другой важной его характеристикой является величина, называемая "окисленностью" шлака. Эта величина характеризует способность шлака окислять металл и его примеси. В качестве меры окисленности обычно принимают или содержание (в %) в шлаке FeO, или содержащуюся в нем сумму FeO + Fe203) или содержание в шлаке железа. Существуют й другие способы определения окисленности шлака.
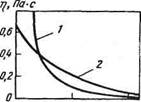
Помимо химического состава, важнейшей характеристикой шлака является его вязкость, которая обычно значительно выше вязкости стали. При температуре около 1600 °С вязкость стали составляет 0,0025 Па • с; вязкость относительно жидких шлаков равна 0,02—0,04 Па • с, густых - выше 0,2 Па • с (рис. 77).
Увеличение степени перегрева над температурой плавления повышает жидкотекучесть шлаков. С помощью диаграмм состояния можно определить пути снижения температуры плавления реальных шлаков. Обычно для разжижения основных шлаков используют добавки боксита (основные составляющие А12Оэ, Si02, Fe203), плавикового шпата (CaF2) , боя шамотного кирпича (Si02, Al203), в некоторых случаях песка (Si02); для "сгущения" основных шлаков используют добавки извести (СаО), иногда — магнезита (MgO). Наоборот, добавки песка (Si02) "сгущают" кислые шлаки, а добавки извести их разжижают.
*По мерс ужесточения требований, связанных с охраной природы, использование фторсодержащих реагентов сокращается.
|
Рис. 77. Зависимость вязкости
шлаков (Т)) от температуры:
| то |
/ — основные ("короткие") шлаки;
| 1500 |
г, С 2 - кислые ("длинные") шлаки
Роль шлака в сталеплавильном производстве чрезвычайно велика. Удаление, например, из металла таких вредных примесей, как сера и фосфор, заключается в переводе этих элементов в шлак и создании условий, препятствующих их обратному переходу из шлака в металл. Изменяя состав шлака, его количество и температуру, можно добиться увеличения или уменьшения содержания в металле марганца, кремния, хрома и других элементов. Поэтому во многих случаях задача сталеплавильщика заключается в получении шлака необходимой консистенции и химического состава.
4. Основные реакции сталеплавильных процессов
Поскольку сталь получают обычно из чугуна и лома в результате окисления и удаления содержащихся в них примесей (кремния, марганца, фосфора и др.), особое значение в сталеплавильной практике имеют реакции окисления. Кислород для протекания этих рекций поступает или из атмосферы, или из железной руды, или из других окислителей, или при продувке ванны газообразным кислородом.
При контакте с металлом и шлаком окислительной атмосферы, содержащей кислород в виде Оа, С02 или Н20, образуются высшие оксиды железа, обогащающие шлак кислородом (например, СОг + 2(FeO) = (Fe203) + СО). Дальнейший процесс переноса кислорода из шлака в металл протекает по реакциям (Fe203) + Реж=3(РеО), а затем (FeO) —*[0] + Fe*.
Ниже рассмотрены основные реакции, происходящие при протекании сталеплавильных процессов. При этом для простоты расплавленная сталь будет рассматриваться как однородный раствор тех или иных компонентов в железе независимо от того, какая структура была у металла данного состава в твердом состоянии. Следует иметь в виду, что такое допущение не совсем верно. Температура плавления стали в зависимости от состава колеблется обычно в пределах 1400—1530 °С, а перед выпуском фактически составляет обычно 1550—1650 °С. Таким образом, рассматриваются расплавы, относительно слабо перегретые по сравнению с линией ликвидуса. У таких расплавов влияние типа структуры, свойственной твердому состоянию, сохраняется и при температурах, превышающих линию ликвидуса. При этом сохраняется так называемый "ближний" порядок расположения атомов в
температурах; при этом могут образоваться следующие оксиды: Мп02, Мп2Оэ. Мп304, МпО. При высоких температурах устойчивым является оксид МпО. Основная часть находящегося в шихте марганца поступает с чугуном. Определенное количество марганца может содержаться и в стальном ломе, загружаемом вместе с чугуном в сталеплавильные агрегаты.
Марганец, растворенный в металле, окисляется кислородом:
а) содержащимся в газовой фазе
[Мп] + 1/202газ = (МпО); AG° = -361380 - 106,07;
при протекании этой реакции выделяется много тепла;
б) содержащимся в оксидах железа шлака
[Мп] + (FeO) = (МпО) + Fex; AG° = -124000 + 56,47;
эта реакция также экзотермическая;
в) растворенным в металле
[Мп] + [О] = (МпО); AG° = -245000 + 1097;
эта реакция также протекает с выделением тепла.
Из приведенных формул видно, что перед вторым (энтропийным) членом уравнения стоит знак "плюс". Возрастание величины AG° по мере повышения температуры свидетельствует о возможности протекания при высоких температурах обратного процесса — восстановления марганца, в частности, железом: (МпО) = Реж = [Мп] + (FeO).
Марганец могут восстановить также углерод, кремний и другие элементы:
(МпО) + [С] = [Мп] + СОгаз;
2(МпО) + [Si] = 2[Мп] + Si02.
Температура, при которой прекратится окисление марганца и начнется его восстановление, зависит от состава металла и шлака (значения величины AG° для различных составов металла и шлака различны). Для условий, свойственных кислым процессам (кислые шлаки), приходится учитывать, что образующийся при окислении марганца оксид МпО (основной окисел) вступает во взаимодействие с кислотными окислами шлака:
2(MnO) + (Si02) = (MnO)2 * Si02.
Активность закиси марганца в кислом шлаке ниже, чем в основном, поэтому при прочих равных условиях в кислом процессе марганец окисляется легче и более полно, а восстанавливается менее полно, чем в основных. На процессы окисления и восстановления марганца большое влияние оказывает также окисленность шлака. Чем выше окисленность шлака, тем полнее окисляется марганец и тем более высокая температура требуется для его восстановления.
Окисление и восстановление кремния
Кремний растворяется в железе в любых соотношениях. Растворение кремния в железе происходит с выделением тепла:
Si -^[Si]; AG° =-121400 - 1,27.
Основная масса кремния, содежащегося в шихте, поступает в нее с чугуном.
Кремний — элемент легко окисляющийся. Растворенный в металле кремний может окисляться кислородом:
а) содержащимся в газовой фазе
[Si] + Оггю = (Si02); AG° = -775670 + 1987;
б) содержащимся в окислах железа шлака
[Si] + 2(FeO) = (Si02) + 2Реж; AG0 = -300000 + 987;
в) растворенным в металле
[Si] + 2[0] = Si02; AG0 = -541840 + 2037.
Все эти реакции сопровождаются выделением очень большого количества тепла.
Для некоторых процессов (например, бессемеровского) кремний является основным "топливом", т.е. тем элементом, в результате окисления которого происходит нагрев металла. Знак "плюс" перед энтропийными членами в уравнениях свободной энергии свидетельствует о том, что при повышении температуры могут создаваться благоприятные условия для восстановления кремния. Восстановление его при повышении температуры действительно происходит в кислых процессах, под кислыми шлаками, когда активность Si02 в шлаке (и в футеровке) высока, а окисленность шлака мала. Повышение окисленности шлака благоприятствует процессам окисления кремния и препятствует его восстановлению.
15-38Ш 225

 Восстанавливать кремний из кислого шлака (а также из кислой футеровки) могут железо, углерод или марганец.
Восстанавливать кремний из кислого шлака (а также из кислой футеровки) могут железо, углерод или марганец.
Окисление и восстановление фосфора
Фосфор растворяется в железе в значительных количествах. При растворении фосфора выделяется некоторое количество тепла:
?г™ —*2[Р]; AG0 =-245300 - 38Г.
Фосфор обычно считают вредной примесью в стали, и проведению операции по его удалению уделяется большое внимание.
В основе вредного влияния фосфора лежат два его свойства:
1) значительное расширение двухфазной области между линиями ликвидуса и солидуса, вследствие чего при кристаллизации слитка или отливки возникают сильная первичная ликвация (сегрегация), а также значительное сужение у-области, что облегчает развитие сегрегации и в твердом состоянии;
2) относительно малая скорость диффузии фосфора в а- и у- твердых растворах, в результате чего образовавшаяся неоднородность (сегрегация) плохо ликвидируется методами термообработки (особенно в литой стали, не подвергнутой пластической деформации).
Располагающиеся в межзеренном пространстве хрупкие прослойки, богатые фосфором, снижают пластические свойства металла, особенно при низких температурах.
Наиболее вредное влияние фосфора сказывается на стали в присутствии повышенного количества углерода.
В шихту сталеплавильных печей фосфор попадает в основном из чугуна (пустая порода железной руды всегда содержит какое-то количество P2Os, и в процессе доменной плавки фосфор восстанавливается).
Некоторое количество фосфора может попасть в шихту из лома, а также из ферросплавов.
*
Фосфор не всегда является вредной примесью; например, при производстве стали, обрабатываемой на станках-автоматах, когда требуется получение ломкой стружки ("автоматные" стали), при производстве чугуна для фасонного литья (фосфор повышает жидкотекучесть) и в некоторых других случаях.
Растворенный в металле фосфор может окисляться кислородом:
а) содержащимся в газовой фазе
4/5[Р] + 02газ = 2/5(P2Os); AG° = -619280 + 175Г;
б) содержащимся в оксидах железа шлака
4/5[Р] + 2[FeO] = 2/5(P2Os) + 2Fex;
AG0 - -143050 + 66Г;
в) растворенным в металле
4/5[Р] + 2[0] = 2/5(P2Os); AG° = -385220 + 170Г.
Во всех случаях окисление растворенного в металле фосфора сопровождается выделением тепла. В случае окисления фосфора газообразным кислородом выделяется очень большое
количество тепла.
Для некоторых процессов, связанных с переделом фосфористых чугунов (например, томасовского), фосфор является основным "топливом", т.е. элементом, в результате окисления которого происходит нагрев металла.
Знак "плюс" перед энтропийными членами в уравнениях свободной энергии свидетельствует о том, что при повышении температуры могут создаться благоприятные условия для восстановления фосфора. Повышение окисленности шлака благоприятствует процессам окисления фосфора и, наоборот, снижение активности окислов железа в шлаке затрудняет протекание этих процессов.
Приведенные выше данные изменения величины AG° получены в случае чистых железистых шлаков. В реальных шлаках всегда содержится какое-то количество Si02 и других компонентов, снижающих активность окислов железа. В результате оказывается, что при работе под такими шлаками фосфор, перешедший в шлак при относительно низких температурах, при повышении температуры может начать восстанавливаться и при обычных температурах сталеварения (> 1500 °С) практически весь перейти обратно в металл.
Таким образом, при относительно низкой температуре фосфор может удаляться с сильно железистыми шлаками. При этом образуются фосфаты железа:
m(FeO) + (P2Os) = (FeO)m • (P2Os) (m > 3).
 Могут образовываться также такие фосфаты железа, как, например, (Fe203) ■ (P2Os), (Fe2Q3)2 ■ (P2Os). Однако при высоких температурах эти соединения непрочны и фосфор может перейти обратно в металл. Для того, чтобы удалить фосфор из металла и удержать его в шлаке, необходимо снижать активность P2Os в шлаке. Этого достигают при наведении основного шлака с помощью добавок извести (или известняка). Основная составляющая извести — СаО реагирует с P2Os, образуя прочные соединения типа (СаО)4 ■ (Р205) или (СаО)з • (P2Os). При взаимодействии металла со шлаком, содержащим окислы железа и кальция, протекает реакция
Могут образовываться также такие фосфаты железа, как, например, (Fe203) ■ (P2Os), (Fe2Q3)2 ■ (P2Os). Однако при высоких температурах эти соединения непрочны и фосфор может перейти обратно в металл. Для того, чтобы удалить фосфор из металла и удержать его в шлаке, необходимо снижать активность P2Os в шлаке. Этого достигают при наведении основного шлака с помощью добавок извести (или известняка). Основная составляющая извести — СаО реагирует с P2Os, образуя прочные соединения типа (СаО)4 ■ (Р205) или (СаО)з • (P2Os). При взаимодействии металла со шлаком, содержащим окислы железа и кальция, протекает реакция
2[Р] + 5(FeO) + 4(СаО) = (СаО)4 • (Р205) или
2[Р] + 5(FeO) + З(СаО) = (СаО)3 • (Р20$).
При продувке ванны кислородом какая-то часть железа окисляется и образующиеся окислы железа также при наличии основного шлака взаимодействуют с фосфором. Итоговая реакция может быть записана в виде
2[Р] + 27202газ + 4(СаО) = (СаО)4 ■ (P2Os) или
2[Р] + 21/гОггаз + З(Сар) = (СаО), • (Р205).
В ряде случаев для ускорения дефосфорации в металл в струе кислорода вдувают тонкоизмельченную известь или смесь извести и железной руды.
Таким образом при высоких температурах для удаления фосфора из металла необходимо, чтобы шлаки были одновременно и окисленные, и высокоосновные. В кислых процессах при работе под кислыми шлаками удалить фосфор в шлак вообще невозможно (поэтому в кислых процессах шихта должна быть очень чистой). Уменьшить активность (Р205) в шлаке и заставить тем самым реакцию удаления фосфора протекать слева направо можно также, прибегая к смене шлака. Шлак, содержащий какое-то количество фосфора, близкое к равно-' весному с металлом, удаляют из агрегата (скачивают), а вместо него с помощью добавок, не содержащих фосфор, "наводят" новый шлак. После такой операции какое-то количество фосфора из металла опять переходит в "новый" шлак, пока не установится состояние, близкое к равновесию. Операцию скачивания шлака и замены его новым шлаком можно
проводить несколько раз до тех пор, пока в металле не останется очень мало фосфора. Такой метод используют при необходимости получить очень низкие концентрации фосфора в металле. Обычно же достаточной оказывается однократная смена шлака, а при работе на чистой по фосфору шихте шлак вообще не скачивают (кроме фосфора и других вредных примесей, в скачиваемом шлаке содержится также определенное количество железа; эти потери железа снижают выход металла).
Таким образом, можно сформулировать основные условия, соблюдение которых позволяет удалять фосфор из металла (проводить дефосфорацию металла). Эти условия состоят в обеспечении:
1) окислительной среды, высокой активности оксидов железа в шлаке;
2) достаточно высокой основности шлака;
3) наличия шлаков, содержащих мало фосфора, смены (скачивания) шлака;
4) невысокой температуры.
Если в какой-то момент эти условия не будут соблюдены, может произойти обратное восстановление в металл ранее окислившегося фосфора (рефосфорация). Например, бывают случаи, когда в конце плавки резко снижают окисленность шлака. Если при этом температуры металла и шлака были достаточно высоки и шлаки были жидкоподвижны и активны, то после выпуска плавки в ковш во время разливки шлак будет взаимодействовать с футеровкой ковша. Шамотная футеровка ковша, состоящая из Si02 и А1203, будет разъедаться и переходить в шлак (основность CaO/Si02 при этом, естественно, уменьшится). В результате окисленность находящегося в контакте с металлом шлака будет мала и одновременно снизится его основность. Если в шлаке было много фосфора, то фосфор из такого шлака начнет восстанавливаться и переходить в металл, и плавка может быть забракована. Поэтому даже в тех случаях, когда в конце плавки содержание фосфора в металле невелико, сталевар принимает все меры для того, чтобы избежать возможной рефосфорации.
Удаление серы (десульфурация металла)
Сера обладает неограниченной растворимостью в жидком железе и ограниченной в твердом. При кристаллизации стали

 по границам зерен выделяются застывающие в последнюю очередь сульфиды железа. Железо и сульфид железа образуют низкоплавкую эвтектику (температура плавления 988 °С), которая при наличии кислорода (образование оксисульфидов) плавится при еще более низких температурах. Межзеренные прослойки (обычно на микрошлифе они выглядят в виде нитей) фазы, богатой серой, при нагревании металла перед прокаткой или ковкой размягчаются, и сталь теряет свои свойства — происходит разрушение металла (красноломкость). Красноломкость особенно сильно проявляется в литой стали, так как сульфиды и оксисульфиды в этом случае скапливаются по границам первичных зерен. Если сталь хотя бы однократно подвергалась горячей деформации, то вследствие измельчения зерна и образования при деформации новых зерен красноломкость проявляется в гораздо меньшей степени. Однако и в этом случае стремятся получить в стали минимальное содержание серы из-за заметного вредного влияния ее на механические свойства стали (в частности, на величину ударной вязкости), что особенно проявляется в направлении, перпендикулярном оси прокатки или ковки. Повышенное содержание серы приводит часто к появлению так называемых "горячих трешин", особенно при непрерывной разливке стали. Поэтому в большинстве случаев удаление из металла серы — одна из главных задач сталеплавильщика .
по границам зерен выделяются застывающие в последнюю очередь сульфиды железа. Железо и сульфид железа образуют низкоплавкую эвтектику (температура плавления 988 °С), которая при наличии кислорода (образование оксисульфидов) плавится при еще более низких температурах. Межзеренные прослойки (обычно на микрошлифе они выглядят в виде нитей) фазы, богатой серой, при нагревании металла перед прокаткой или ковкой размягчаются, и сталь теряет свои свойства — происходит разрушение металла (красноломкость). Красноломкость особенно сильно проявляется в литой стали, так как сульфиды и оксисульфиды в этом случае скапливаются по границам первичных зерен. Если сталь хотя бы однократно подвергалась горячей деформации, то вследствие измельчения зерна и образования при деформации новых зерен красноломкость проявляется в гораздо меньшей степени. Однако и в этом случае стремятся получить в стали минимальное содержание серы из-за заметного вредного влияния ее на механические свойства стали (в частности, на величину ударной вязкости), что особенно проявляется в направлении, перпендикулярном оси прокатки или ковки. Повышенное содержание серы приводит часто к появлению так называемых "горячих трешин", особенно при непрерывной разливке стали. Поэтому в большинстве случаев удаление из металла серы — одна из главных задач сталеплавильщика .
При растворении серы в железе выделяется тепло, что видно из следующей реакции!
l/2Sra3 —*[S]\ AG° = -72000 - 10,257.
Активность серы в жидком железе зависит от состава расплава. Такие примеси, как углерод, кремний, повышают активность серы в жидком расплаве, так как вытесняют ее из "микроячеек" структуры жидкого металла и занимают ее место. Поэтому, например, при прочих равных условиях обессеривать чугун, содержащий много углерода и кремния, легче, чем обычную сталь.
Сера является поверхностно-активным элементом. На рис. 73 показано уменьшение поверхностного натяжеИия сис-
В некоторых случаях не стремятся получать очень низкие концентрации серы (иногда даже вводят некоторое количество серы в металл). Это бывает в случае выплавки автоматной стали, когда требуется ее хорошая обрабатываемость (например, при полировке стальных изделий в декоративных целях).
темы Fe—S по мере повышения концентрации серы. Высокая поверхностная активность серы приводит к тому, что на поверхности раздела фаз концентрация серы выше, чем в объеме раствора. Поэтому наибольший эффект дает применение таких методов ведения плавки, которые обеспечивают увеличение поверхности контакта металла с десульфурируюшей фазой (искусственное перемешивание металла со шлаком, вдувание в металл тонкоизмельченных порошкообразных реагентов и т.п.).
Элементы, у которых значения изменения свободной энергии AG° при образовании соединений с серой меньше значения изменения свободной энергии при соединении серы с железом, могут быть элементами-десульфураторами. Такими элементами являются Mn, Mg, Na, Ca и др., а также церий (Се) и другие редкоземельные элементы. Все эти элементы используют на практике: натрий в виде соды при внедомен-ной десульфурации чугуна; магний — в виде чистого Mg или сплавов (лигатур) с другими металлами; кальций — иногда в виде сплавов с другими металлами, а чаще в виде извести (СаО) или известняка (СаСОэ); марганец — в виде сплавов марганца с железом (ферромарганца), а также в виде марганцевой руды. Очень большим сродством к сере обладают редкоземельные металлы. Самым дешевым и распространенным из перечисленных материалов является известь.
Основным источником серы в шихте является чугун. Кроме того, определенное количество серы может попасть в металл с ломом (особенно со стружкой, не очищенной от смазочных масел), с добавочными материалами, а также из атмосферы печи, если печь отапливают топливом (мазутом, газом), содержащим серу.
В сталеплавильном агрегате удаление серы из расплавленного металла в шлак происходит в большинстве случаев в результате образования CaS:
Fe + [S] + (СаО) = (CaS) + (FeO),
при этом сера, растворенная в металле, реагирует с СаО в шлаке. Реакция протекает на поверхности раздела фаз, и увеличение этой поверхности (перемешивание металла со шлаком, вдувание в металл СаО в виде порошкообразной извести и другие способы) ускоряет эту реакцию и способствует более глубокой десульфурации. Диффузия серы из глу-


 бины ванны к месту реакции со шлаком- процесс довольно медленный. Перемешивание металла (при кипении ванны, при ее продувке инертными газами или при электромагнитном перемешивании) ускоряет этот процесс. Если шлак, кроме СаО, содержит много МпО, возможно протекание реакции Fe + [S] + (МпО) = (MnS) + (FeO).
бины ванны к месту реакции со шлаком- процесс довольно медленный. Перемешивание металла (при кипении ванны, при ее продувке инертными газами или при электромагнитном перемешивании) ускоряет этот процесс. Если шлак, кроме СаО, содержит много МпО, возможно протекание реакции Fe + [S] + (МпО) = (MnS) + (FeO).
Образующийся при реакциях десульфурации сульфид кальция CaS нерастворим в металле; сульфид марганца MnS также почти нерастворим в металле.
В результате протекания реакций удаления серы из металла общая концентрация серы в шлаке (S) растет, а кон-
ZZZl 7sP)bIrsBl МеТЗЛЛе [S1 *Меньшается- °™>-ние кон-
сепк,ul l] Называют коэффициентом распределения
серы. Чем выше значение этого коэффициента, тем лучше
происходит процесс удаления серы из металла. При повыше
нии температуры ванны значение коэффициента распределения
серы возрастает, так как повышается скорость диффузии се
ры, шлак становится более жидкоподвижным и активным
ускоряется ход самой реакции. дивным,
Скачивание шлака и наведение нового (чистого по сере)
шлака также способствуют переходу новых порций серы из
металла в шлак. р
m,J™T °браГМ' УД^нию серы из металла (десульфурации
металла) способствуют: т/р«".и"
1) наличие основных шлаков с высокой активностью СаО-
2) низкая окисленность металла (минимум [О]) низкая окисленность шлака (минимум FeO); низкая
3) низкая концентрация серы в'шлаке (скачивание и наведение нового шлака);
4) перемешивание металла со шлаком и увеличение поверхности контакта; по
5) повышение температуры ванны
элемеТ" П™ ?"" УКа3аН°' ЧТ° Сера~ п°в<Ф*ност„о-активный
элемент. При продувке металла кислородом окисление серы
адсорбированной „а металле, может в какой-то мере проис
ходить и по реакции V "роис
[S]aac + 02газ = S02ra3.
Однако доля этой реакции в процессах десульфурации невелика, основное количество серы удаляется со шлаком
5. Газы в стали
В любой стали в некоторых количествах содержатся элементы, в обычных условиях являющиеся газами (кислород, водород, азот). Газы содержатся в металлах в виде газовых пузырей, соединений (оксидов, гидридов, нитридов) и жидких или твердых растворов, т.е. в виде атомов или ионов, распределенных между атомами и ионами жидкого металла или внедренных в кристаллическую решетку металла. Газы (даже при содержании их в сотых и тысячных долях процента) оказывают существенное влияние на свойства металла, поэтому вопросам удаления газов из металла всегда уделяют особое внимание.
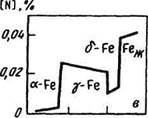
Растворимость газов в стали в сильной степени зависит от температуры (рис. 78).
| Рис. 78. Изменение растворимости встали кислорода (а), водорода (б) и азота (в) |
| t;c |
10).%
| / | ||||
| 0.01 | fe* | |||
| 0.001 | /-Fe | <f-Fe | ||
| «-Fe | / | |||
| / | __________ ь____________ .. ■■■■■■■*_________________________ ... | а |
| 600 |
| //00 |
| 0,003 0,002 |
|
| ^ |
| 0,001 - |
То
| / | ||
| - | сГ-Fe | *я |
| 7-Fe | ||
| «-Fe | ||
| ^-r""j | ' . : |
| 600 WOO 1400 t'C |
500 900 1300 t,'C



 Кислород в стали
Кислород в стали
Атмосфера большинства сталеплавильных агрегатов — окислительная. При окислительном характере газовой фазы какое-то количество кислорода всегда переходит из газовой фазы в металл. Источником кислорода могут быть также добавочные материалы, содержащие оксиды железа (например, ржавчину на поверхности заваливаемого в печи металлического лома). Если в шлаке имеется какое-то количество оксидов железа, то в результате перехода кислорода из шлака в металл между суммарным содержанием оксидов железа в шлаке (FeO) и кислородом в металле [О] устанавливается определенное соотношение (FeO)/[0].
Растворимость кислорода в железе, находящемся под железистым шлаком, с повышением температуры растет. Но если металл содержит примеси, сродство которых к кислороду выше, чем у железа, то происходит окисление этих примесей и концентрация кислорода в металле уменьшается. Если эти примеси вводят в ванну специально для того, чтобы уменьшить содержание кислорода, то их называют раскислителями. В качестве таких элементов-раскислителей используют марганец, кремний, алюминий, кальций, редкоземельные элементы. Раскислителем является также углерод.
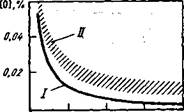
Кислород, растворенный в металле, реагирует с углеродом, и в результате реакции [О] + (С] = СОгаз происходит кипение металла. При кипении ванны содержание кислорода определяется уже не соотношением (FeO)/[0], а содержанием углерода (рис. 79). Константа равновесия реакции [О] + + [С] = СОг может быть выражена в виде К - р /([0][С]),
откуда [0] = р/К [С].
|
Рис. 79. Влияние углерода на содержание кислорода, растворенного в стали:
/ — равновесная кривая [С] " [О] ~
~ 0,0025; /7 — область концентраций,
фактически наблюдаемых при кипении
О 0,2 0,4 0.S ИЯ,% металла
Если уменьшить давление (например, при помещении ковша с жидким металлом в вакуумную камеру), то равновесие этой реакции сместится вправо, металл, содержащий углерод, вскипит, и содержание кислорода уменьшится. Таким образом, если металл не содержит примесей, то содержание кислорода в нем зависит от окисленности шлака и температуры. Если в металле имеются активные по отношению к кислороду примеси, то окисленность металла зависит от активности этих примесей. Если металл "кипит", то окисленность металла зависит от содержания углерода.
Водород в стали
Атмосфера почти любого сталеплавильного агрегата содержит какое-то количество водорода или паров Н20. Некоторое количество влаги может попасть вместе с шихтой и добавочными материалами. Из атмосферы агрегата водород переходит в металл по реакции
Н2газ -*2[Н] или Н2Огаз — 2[Н] + [0].
Константа первой реакции может быть выражена в виде
к = [н]7рн ,
"ггаз откуда
[н] = //ср„ =г/7
"ггаз "ггаз
Пропорциональность содержания водорода в металле корню квадратному из давления водорода в газовой фазе называют "законом квадратного корня". Растворимость водорода в твердом металле для различных модификаций железа различна (рис. 78, б). Скачкообразное изменение растворимости при переходе металла из одного аллотропического состояния в другое вызывает интенсивное выделение из него водорода, сплошность металла нарушается, образуются такие дефекты, например, как флокены (особой формы газовые пузыри). Оставшийся в твердом растворе водород искажает кристаллическую решетку металла, в результате чего его хрупкость возрастает, а пластичность уменьшается, качество металла ухудшается. Для снижения содержания водорода в металле и ослабления его вредного влияния на качество применяют указанные ниже методы.
 Обработка металла вакуумом. Соотношение между количеством водорода, растворенного в металле, и давлением водорода в газовой фазе определяется выражением [Н] =
Обработка металла вакуумом. Соотношение между количеством водорода, растворенного в металле, и давлением водорода в газовой фазе определяется выражением [Н] =
=K'v p . При помещении металла в вакуумную камеру дав-Н2газ
ление водорода в газовой фазе уменьшается, и он начинает
удаляться из металла. Вакуум является очень эффективным
средством уменьшения содержания водорода в металле.
Организация кипения ванны. При протекании реакций окисления углерода образуется оксид углерода. Пузырьки СО, проходя через ванну, создают эффект кипения. Парциальное давление водорода в пузырьке, состоящем из СО, равно нулю, поэтому пузырьки СО по отношению к водороду (а также к азоту) являются как бы маленькими вакуумными камерами, и эти газы уходят из металла в пузырьки СО и вместе с ним покидают ванну. Таким образом, при кипении металл очищается от растворенных в нем газов.
Продувка инертными газами. При продувке металла инертными газами (обычно для этой цели используется самый дешевый и доступный инертный газ — аргон) через ванну проходят тысячи пузырьков газа. Парциальное давление водорода в этих пузырьках равно нулю, поэтому они очищают металл от водорода. Одновременно с удалением газов продувка аргоном обеспечивает перемешивание металла, выравнивание его состава, температуры и т.д.
Выдержка закристаллизовавшегося металла при повышенных температурах. Размеры атомов водорода очень малы, они свободно диффундируют через кристаллическую решетку закристаллизовавшейся стали, особенно при повышенных температурах. Из образцов сравнительно небольшого сечения, охлаждаемых медленно в печи или на воздухе, растворенный при высоких температурах водород удаляется почти полностью, до значений растворимости, соответствующих ничтожной равновесной растворимости (в зависимости от содержания Н20' в воздухе). Принято содержание водорода в металле выражать в кубических сантиметрах на 100 г массы пробы. Обычно содержание водорода в жидкой стали в зависимости от метода работы колеблется от 4 до 10 см3 на 100 г металла. Чем больше масса изделия, тем затруднительнее организовать удаление водорода из затвердевшего металла. Поэтому все слитки качественного металла (или
заготовки из них) длительное время выдерживают при отно сительно высоких температурах, для чего в цехах существуют специальные пролеты. Для очень больших слитков (* 30 т), из которых отковывают ответственные изделия (коленчатые валы, роторы и т.п.), такой способ уже не дает должного эффекта, и такие слитки отливают под вакуумом.
Добавки гидридообразующих элементов. Некоторые металлы (например, редкоземельные) способны вступать с водородом во взаимодействие, образуя гидриды. При введении этих элементов в металл развитие таких дефектов, как флокены, уменьшается.
Наложение электрического поля. Водород, растворенный в жидком металле, находится там в виде катиона Н+, а в шлаке—в виде ОН". При наложении достаточно сильного электрического поля на катоде выделяется атомарный водород Н+ + е = Н, атомы которого ассоциируются в молекулы Н + Н = Н2газ. На аноде из шлака выделяются пары Н20 и 02: 40Н~ = 2Н20 + 02 + 4е. В промышленных условиях этот способ удаления водорода применения не нашел.
Несмотря на наличие многих методов борьбы с водородом в стали, необходимо использовать все способы, чтобы исключить попадание водорода в металл (минимальная влажность воздуха, кислорода, топлива, минимум влаги в добавочных материалах и т.п.).
Азот в стали
Азот почти всегда присутствует в атмосфере сталеплавильного агрегата. Растворение в металле азота, так же как и водорода, подчиняется закону квадратного корня [N] =
= Ку р , следовательно, процесс растворения азота
N2ra3
может быть записан как N2ra3 = 2[N]. При обычных температурах сталеплавильных процессов (1450—1600 °С) интенсивность перехода азота в металл из газовой фазы невелика. Однако при очень высоких температурах, превышающих 2500 °С (например, в зоне электрических дуг при выплавке стали в дуговых электропечах, в зоне контакта кислородной струи с металлом при продувке ванны кислородом), молекулы азота диссоциируют и скорость проникновения в металл атомов азота может резко возрасти.
 На растворимость азота в металле влияет также его состав. Примеси, образующие прочные нитриды (хром, марганец, ванадий, титан, алюминий, церий и другие редкоземельные металлы), повышают растворимость азота в стали; примеси, не образующие нитридов (углерод, фосфор) или образующие непрочные нитриды (кремний), но сами вступающие с железом в химическое взаимодействие, заметно снижают растворимость азота.
На растворимость азота в металле влияет также его состав. Примеси, образующие прочные нитриды (хром, марганец, ванадий, титан, алюминий, церий и другие редкоземельные металлы), повышают растворимость азота в стали; примеси, не образующие нитридов (углерод, фосфор) или образующие непрочные нитриды (кремний), но сами вступающие с железом в химическое взаимодействие, заметно снижают растворимость азота.
Размеры частиц азота, растворенного в металле, гораздо больше размеров частиц водорода, скорость диффузии в металле у них меньше. Поверхностно-активные примеси в металле препятствуют переходу азота через поверхность контакта фаз и затрудняют удаление азота.
Растворимость азота в железе изменяется в зависимости от температуры и состава металла (рис. 78, в).
Резкое снижение растворимости азота при переходе из жидкого в твердое состояние и при превращении y-Fe в a-Fe в случае быстрого охлаждения металла приводит к получению перенасыщенного азотом твердого раствора, из которого в процессе эксплуатации по границам зерен выделяются нитриды, повышающие твердость, увеличивающие хрупкость и снижающие пластичность ("старение" металла).
Особенно вредно ухудшение свойств металла, в котором много азота, при эксплуатации в условиях низких температур.
Ниже указаны основные мероприятия, способствующие получению стали с минимальным содержанием азота:
1) использование чистых по азоту шихтовых материалов;
2) организация кипения ванны (удаление азота с пузырьками СО) или продувка металла инертными газами;
3) предохранение металла от соприкосновения с азотсодержащей атмосферой в зоне очень высоких температур или искусственное охлаждение этой зоны;
4) использование для продувки кислорода, не содержащего примесей азота;
5) связывание азота в прочные нитриды при введении в сталь нитридообразующих элементов (например, алюминия при производстве низкоуглеродистой "нестареющей" стали);
6) обработка металла вакуумом.
6. Неметаллические включения
Неметаллическими включениями называют содержащиеся в стали соединения металлов (железа, кремния, марганца, алюминия, церия и др.) с неметаллами (серой, кислородом, азотом, фосфором, углеродом). Количество неметаллических включений, их состав, размеры и характер расположения в готовом изделии оказывают существенное, а иногда решающее влияние на свойства стали. Неметаллические включения ухудшают не только механические (прочность, пластичность), но и другие свойства стали (магнитную проницаемость, электропроводность и др.), так как нарушают сплошность металла и образуют полости, в которых концентрируются напряжения в металле. Неметаллические включения принято разделять на две группы: 1) включения, образующиеся в процессе реакций металлургического передела (эндогенные1 включения) и 2) включения, механически попадающие в сталь (экзогенные2 включения). Эти включения представляют собой частицы загрязнений, бывших в шихте и не удалившихся из металла в процессе плавки, частицы оставшегося в металле шлака, частицы попавшей в металл футеровки желоба, ковша.
Эндогенные включения непрерывно образуются в металле в процессе плавки, разливки и кристаллизации слитка или отливки. Большая часть образовавшихся включений успевает всплыть и удалиться в шлак, однако какая-то часть остается. В литой стали включения присутствуют в виде кристаллов и глобулей. После обработки давлением (прокатки, ковки, штамповки) они меняют форму и расположение и видны под микроскопом в виде нитей, строчек, цепочек, ориентированных преимущественно в направлении деформации. Включения в зависимости от химического состава принято делить на сульфиды (FeS, MnS и т.п.), оксиды (FeO, MnO, Si02, А1203 и т.п.) и нитриды (TiN, ZrN и т.п.). Кроме того, иногда выделяют также фосфиды и карбиды.
Очень часто включения представляют собой довольно сложные соединения типа силикатов (nFeO • mMnO ■ pSi02), алюмосиликатов (лМпО • mSi02 • рА\2Оъ), шпинелей (FeO • • Al203), оксисульфидов и т.д.
От греч. endo — внутри и genos — род, рождение !От греч. ехо — вне и genos.
 Эндогенные неметаллические включения образуются в: результате взаимодействия растворенных в металле компонентов или уменьшения их растворимости при застывании стали. Образующиеся включения легче металла (табл. 3), они стремятся всплыть. Скорость их всплывания зависит от размеров включений, вязкости металла, смачиваемости включений металлом и шлаком, движения (перемешивания) металла и шлака. Р
Эндогенные неметаллические включения образуются в: результате взаимодействия растворенных в металле компонентов или уменьшения их растворимости при застывании стали. Образующиеся включения легче металла (табл. 3), они стремятся всплыть. Скорость их всплывания зависит от размеров включений, вязкости металла, смачиваемости включений металлом и шлаком, движения (перемешивания) металла и шлака. Р
Дата добавления: 2015-06-22; просмотров: 1219;
