Кинетика ферментативного катализа
Катализатор – вещество, увеличивающее скорость реакции, но не участвующее в образовании конечных продуктов.
Ферменты – биологические катализаторы, высокомолекулярные белки.
Математическая модель ферментативного катализа была разработана Л.Михаэлисом и М.Ментен в 1913 году и представляет собой решение системы уравнений:
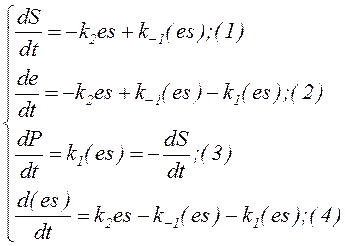

Опять же будем исходить из условия закрытости системы:
1) Весь продукт реакции образуется из субстрата: P+S=const;
2) Существует начальная концентрация фермента: e0=const=e+(es).
Из первого условия следует:
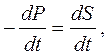 а из второго:
а из второго: 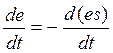 .
.
Подставим e+(es)=e0=const в уравнение (4), получим:
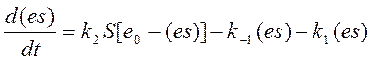
или: 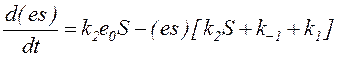
В начальный момент времени 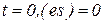 и при
и при 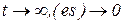 , следовательно, функция es (от t) имеет экстремум – максимальное значение, где ее производная равна нулю:
, следовательно, функция es (от t) имеет экстремум – максимальное значение, где ее производная равна нулю:
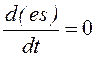
Это область стационарного состояния, когда скорость реакции максимальна, а концентрация [S] не лимитирует течение процесса, то есть S=S0+P>e0.
При этом условии стационарности можно записать; что:
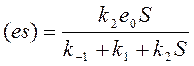 , или:
, или: 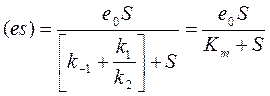 , где
, где
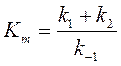 – концентрация субстрата, при котором (es)=e0/2, то есть половина энергии задействовано и:
– концентрация субстрата, при котором (es)=e0/2, то есть половина энергии задействовано и: 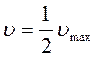 .
.
Для стационарного состояния:
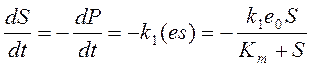
Совмещая 3-е уравнение системы с полученным выражением:
Так как 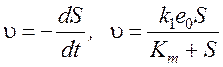 .
.
k1e0 -это произведение отражает максимальную скорость реакции, когда S находится в большом избытке, и тогда реакция подчиняется уравнению 1-го порядка:
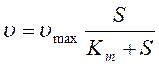 .
.
Линейные преобразования уравнения Михаэлиса-Ментен
Линеанизацию уравнения Михаэлиса-Ментена можно производить тремя способами:
1. Способ Ленгмюра:
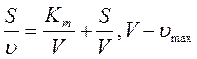 , tg=1/V
, tg=1/V
2. Способ Эди-Хофети:
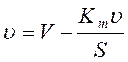 , tg=-Km
, tg=-Km
3. Способ Лайнувера-Бэрка (Рис.2,1)
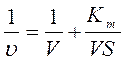 , tg=Km/V
, tg=Km/V
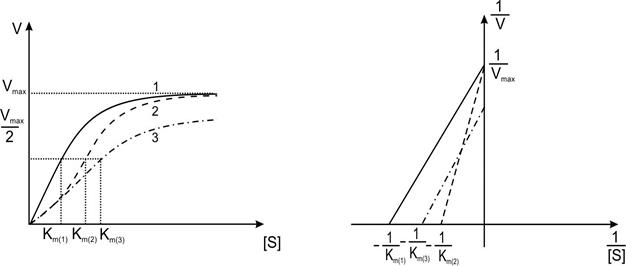
|
| Рис.2. Графическое отражение зависимости скорости ферментативной реакции (V) от концентрации субстрата (S) в прямых (правый рисунок) и обратных (левый рисунок) координатах. Сплошная линия (1) -исходная кривая; пунктирная (2)-конкурентное ингибирование; штрих-пунктирная (3)-неконкурентное ингибирование. |
Ингибирование ферментов
Существует много веществ, ингибирующих протекание ферментативных реакций, как обратимо, так и необратимо:
Конкурентное ингибирование (Рис.2)- это когда ингибитор I занимает активный центр фермента, образуя EI, и не дает образовывать ES.
Так как это случай разветвлённой цепи реакции:
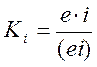 .
.
Из выше изложенного можно записать, что
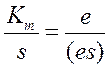 или
или 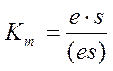 ,
,
но в нашем случае e=e0-(es)-(ei)
и тогда
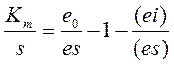
Из закона действующих масс:
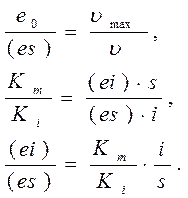 ,
,
тогда, подставляя:
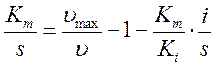 ,
,
можно преобразовать по Лайнуверу-Бэрку:
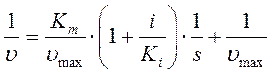
Неконкурентное ингибирование(Рис2).
Это более редкий случай, когда у фермента, кроме активного центра, существует ещё и регуляторный (аллостерический) центр, с которым и взаимодействует ингибитор.
Как и в предыдущем случае 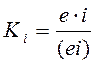 , а при
, а при 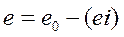
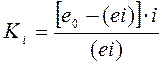 и
и 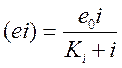 ,
,
Если снижение скорости ферментативного катализа при действии ингибитора определяется соотношением:
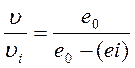 , то, используя предыдущее уравнение, получим:
, то, используя предыдущее уравнение, получим:
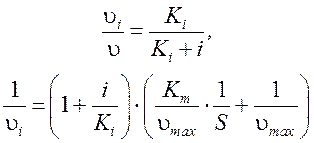
При этом изменяется 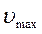 и
и 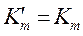 , тогда:
, тогда:
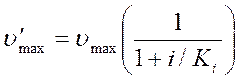 .
.
Чисто неконкурентное ингибирование встречается крайне редко, так как связывание ингибитора с аллостерическим центром практически неизбежно влияет на сродство активного центра к субстрату. Поэтому, как правило, выделяют смешанное ингибирование, когда изменяются и 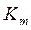 , и
, и 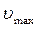 .
.
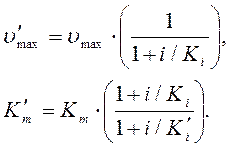
где 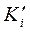 - и
- и 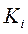 - константы диссоциации комплекса.
- константы диссоциации комплекса.
В таком случае прямая 1 на рис.2 сместится и по углу, и по осям.
Бесконкурентное ингибирование.
Можно отметить, что в случае, когда 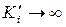 , смешанное ингибирование превращается в конкурентное. Противоположностью ему является неконкурентное ингибирование, которое оказывается где-то в стороне, а ещё один вид, когда
, смешанное ингибирование превращается в конкурентное. Противоположностью ему является неконкурентное ингибирование, которое оказывается где-то в стороне, а ещё один вид, когда 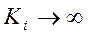 ,
,
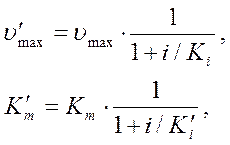
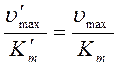 .
.
Этот тип осуществляется в той ситуации, когда:
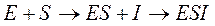 ,- то есть, чтобы осуществить ингибирование, сначала должен образоваться EI комплекс.
,- то есть, чтобы осуществить ингибирование, сначала должен образоваться EI комплекс.
Влияние температуры на скорость ферментативных реакций
Причина влияния не в законе Аррениуса, а преимущественно в обратимой денатурации белка. Денатурация – образование неактивной формы фермента. 
Понятие температурного оптимума необходимо применять осторожно, так как денатурация процесс медленный, и результат будет зависеть от времени инкубации.
Влияние рН на скорость ферментативных реакций
Молекула фермента содержит значительное число кислых и основных групп. При рН 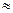 7 они либо полностью депротонированы (аспартат, глутамат), либо полностью пртонированы (аргинин, лизин). Однако группы гистидина (имдазольная) и цистеина (сульфгидрильная) имеют рК в диапазоне от 5 до 9.
7 они либо полностью депротонированы (аспартат, глутамат), либо полностью пртонированы (аргинин, лизин). Однако группы гистидина (имдазольная) и цистеина (сульфгидрильная) имеют рК в диапазоне от 5 до 9.
Максимум активности фермента достигается при:
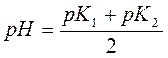 ,
,
а ширина оптимума зависит от:
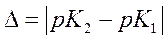 .
.
Чем он больше, тем больше оптимум (диапазон рН, в котором активность больше 50%).
при 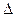 =0,5 оптимум 1,5 единиц рН
=0,5 оптимум 1,5 единиц рН
при 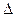 =1 оптимум 1,7 единиц рН
=1 оптимум 1,7 единиц рН
при 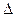 =2 оптимум 2,3 единиц рН
=2 оптимум 2,3 единиц рН
при 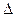 =3 оптимум 3,1 единиц рН
=3 оптимум 3,1 единиц рН
Кроме того, важно отметить, что от рН зависит в основном Vmax, Km -почти не зависит, так как это константа равновесия процесса, рН не влияет на взаимодействие субстрата с ферментом (неконкурентный характер ингибирования).
Дата добавления: 2015-06-22; просмотров: 1899;
