ОПРЕДЕЛЕНИЕ ОТНОШЕНИЯ ТЕПЛОЕМКОСТЕЙ ВОЗДУХА (Ср/Су) МЕТОДОМ КЛЕМАНА И ДЕЗОРМА
Теплоемкостью какого-либо тела Ст называется физическая величина,
численно равная количеству теплоты, которое нужно сообщить телу, чтобы повысить его температуру на один градус:
Ст = 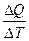
Теплоемкость единицы массы вещества называется удельной теплоемкостью и обозначается Суд.
Теплоемкость моля вещества называется молярной теплоемкостью и обозначается С.
Удельная и молярная теплоемкости связаны между собой соотношением:
Для газов удельная теплоемкость (а также молярная) существенно зависит  от условий, при которых производится нагревание газа. Если нагревание происходит при постоянном давлении, то все подводимое количество теплоты идет на увеличение внутренней энергии газа и работу по расширению газа. При нагревании газа при постоянном объеме работа по расширению газа не совершается и поэтому требуется меньшее количество теплоты. Поэтому для газов следует различать две удельные (а значит и молярные) теплоемкости –
от условий, при которых производится нагревание газа. Если нагревание происходит при постоянном давлении, то все подводимое количество теплоты идет на увеличение внутренней энергии газа и работу по расширению газа. При нагревании газа при постоянном объеме работа по расширению газа не совершается и поэтому требуется меньшее количество теплоты. Поэтому для газов следует различать две удельные (а значит и молярные) теплоемкости –
при постоянном давлении Ср и при постоянном объеме Су.
Молярная теплоемкость газа при постоянном объеме газа равна:
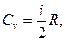
где i-число степеней свободы молекул газа,
R-универсальная газовая постоянная.
Молярная теплоемкость газа при постоянном давлении равна:
Ср.= 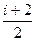
Отношение молярных теплоемкостей Ср/ Су. Обозначается γ и равно:
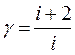
Из формулы видно, что γ зависит только от числа степеней свободы молекул газа. Напомним, что числом степеней свободы называется число независимых координат определяющих положение тела в пространстве. Для одноатомной молекулы число степеней свободы равно 3, для двухатомной – 5, для трехатомной молекулы – 6.
Отношение теплоемкости газа γ является важной характеристикой. Оно входит в уравнение Пуассона, описывающее адиабатические процессы.
Адиабатическими процессами называются такие процессы, при которых не происходит теплообмена газа, с окружающей средой. Очень быстро протекающие процессы, при которых не происходит теплообмена газа с окружающей его средой являются адиабатическими. По понятным соображениям, очень быстро протекающие процессы сжатия или расширения газа являются адиабатическими. Адиабатические расширения или сжатия газа сопровождаются изменением его внутренней энергии, а следовательно, и температуры.
При адиабатическом сжатии температура газа повышается, а при адиабатическом расширении-понижается.
Уравнение Пуассона можно записать через любую пару переменных: pV, T, PТ: 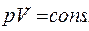
TV 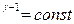
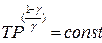
II. ОПИСАНИЕ ЭКСПЕРИМЕНТАЛЬНОЙ УСТАНОВКИ
Лабораторная установка (рис.1) состоит из стеклянного баллона Б, закрытого пробкой. В пробку вставлен стеклянный четверник, с помощью которого баллон соединен с манометром М, насосом Н и атмосферой (кран К). В шланг, соединяющий баллон с насосом, вставлен кран П, служащий для прекращения выхода воздуха после накачивания его в баллон.
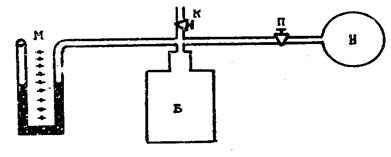
Рис.1
Рассмотрим ход опыта Клемана и Дезорма. Открыв кран П и закрыв кран К, насосом накачивают воздух в баллон, при этом воздух сжимается, а его температура и давление повышаются. Через некоторое время, благодаря теплопроводности стен баллона, воздух внутри него охладится до температуры окружающей среды, при этом в манометре установится некоторая разность уровней жидкости в правом и левом коленах. Обозначим разность уровней через разность h1. Она показывает, на сколько давление внутри баллона больше атмосферного.
Если обозначить атмосферное давление P0, то давление внутри баллон будет равно P0+h1 (конечно P0 и h1 должны быть выражены в одних и тех же единицах).
Значит, первое состояние газа можно описать следующими параметрами:
P0+h1 – давление воздуха внутри баллона,
V1 – объем некоторой массы воздуха внутри баллона,
Т1 – температура воздуха внутри баллона, равная температуре окружающей среды.
Откроем кран К на время, пока давление в баллоне не станет атмосферным (P0), при этом часть воздуха выйдет из баллона и в самом баллоне воздух расширится. Процесс расширения воздуха происходит достаточно быстро и его можно считать адиабатическим. Следовательно, газ совершат работу по расширению за счет уменьшения его внутренней энергии, а значит его температура понижается.
Тогда второе состояние газа можно описать параметрами:
P0 – Давление воздуха, равное атмосферному давлению,
V2 – объем газа,
Т2 – температура воздуха внутри баллона, ставшая меньше чем Т1.
Через некоторое время воздух внутри баллона нагревается до температуры окружающей среды, при этом его объем не изменяется, следовательно, увеличивается давление. В манометре установится некоторая разность уровней жидкости в правом и левом коленах.
Третье состояние газа можно описать следующими параметрами:
Р.о+h2 – давление воздуха внутри баллона,
V2 – объем газа,
Т1 – температура газа.
Сравнивая первое и третье состояние газа, можно заменить, что температуры одинаковы, следовательно, можно применить закон Бойля – Мариотта: «Для данной массы газа при постоянной температуре давление газа изменяется обратно пропорционально объему»:
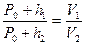 , (1)
, (1)
Переход газа из первого во второе состояние, как уже отмечалось, произошел адиабатически; следовательно, применим закон Пуассона в виде
PVγ = const:
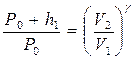 , (2)
, (2)
 Сопоставляя формулы (1) и (2), получим:
Сопоставляя формулы (1) и (2), получим:
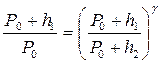 .
.
Прологарифмируем последнее выражение:
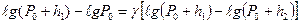 .
.
Из него найдем γ:
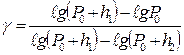 , (3)
, (3)
Так как давление Р0, Р0 + h1, Р0 +h2 незначительно отличаются друг от друга, то в формуле (3) отношение разности логарифмов можно заменить отношением разность самих чисел Р0, Р0 + h1, Р0 +h2. Тогда получим:
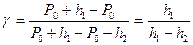 . (4)
. (4)
Формула (4) является расчетной для определения отношения теплоемкости.
Дата добавления: 2015-06-17; просмотров: 1858;
