ЗАРЯД ЯДРА
Закон Мозли. Электрический заряд ядра образуют протоны, входящие в его состав. Число протонов Z называют его зарядом, имея ввиду, что абсолютное значение заряда ядра равно Ze. Заряд ядра совпадает с порядковым номером Z элемента в периодической системе элементов Менделеева. Впервые заряды атомных ядер определил английский физик Мозли в 1913 году. Измерив с помощью кристалла длину волны λ характеристического рентгеновского излучения для атомов некоторых элементов, Мозли обнаружил регулярное изменение длины волны λ у элементов, следующих друг за другом в периодической системе (рис.2.1). Это наблюдение Мозли интерпретировал зависимостью λ от некоторой константы атома Z, изменяющейся на единицу от элемента к элементу и равной единице для водорода:
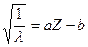 , (2.1)
, (2.1)
где 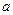 и
и 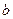 - постоянные. Из экспериментов по рассеянию рентгеновских квантов атомными электронами и α-частиц атомными ядрами уже было известно, что заряд ядра примерно равен половине атомной массы и, следовательно, близок к порядковому номеру элемента. Поскольку испускание характеристического рентгеновского излучения является следствием электрических процессов в атоме, Мозли сделал вывод, что найденная в его опытах константа атомов, определяющая длину волны характеристического рентгеновского излучения и совпадающая с порядковым номером элемента, может быть только зарядом атомного ядра (закон Мозли).
- постоянные. Из экспериментов по рассеянию рентгеновских квантов атомными электронами и α-частиц атомными ядрами уже было известно, что заряд ядра примерно равен половине атомной массы и, следовательно, близок к порядковому номеру элемента. Поскольку испускание характеристического рентгеновского излучения является следствием электрических процессов в атоме, Мозли сделал вывод, что найденная в его опытах константа атомов, определяющая длину волны характеристического рентгеновского излучения и совпадающая с порядковым номером элемента, может быть только зарядом атомного ядра (закон Мозли).

Рис. 2.1. Рентгеновские спектры атомов соседних элементов, полученные Мозли
Измерение длин волн рентгеновского излучения выполняется с большой точностью, так что на основе закона Мозли принадлежность атома к химическому элементу устанавливается абсолютно надежно. Вместе с тем тот факт, что константа Z в последнем уравнении является зарядом ядра, хотя и обоснован косвенными экспериментами, в конечном счете держится на постулате – законе Мозли. Поэтому после открытия Мозли заряды ядер многократно измерялись в опытах по рассеянию α-частиц на основе закона Кулона. В 1920 году Чедвиг усовершенствовал методику измерения доли рассеянных α-частиц и получил заряды ядер атомов меди, серебра и платины (см. таблицу 2.1). Данные Чедвига не оставляют сомнений в справедливости закона Мозли. Помимо указанных элементов в экспериментах были определены также заряды ядер магния, алюминия, аргона и золота.
Таблица 2.1. Результаты опытов Чедвика
| Элемент | Порядковый номер Z | Заряд Z из эксперимента |
| Cu | 29,3 | |
| Ag | 46,3 | |
| Pt | 77,4 |
Определения. После открытия Мозли стало ясно, что основной характеристикой атома является заряд ядра, а не его атомная масса, как это предполагали химики 19 века, ибо заряд ядра определяет число атомных электронов, а значит, химические свойства атомов. Причина различия атомов химических элементов как раз и состоит в том, что их ядра имеют разное число протонов в своем составе. Напротив, разное число нейтронов в ядрах атомов при одинаковом числе протонов никак не меняет химические свойства атомов. Атомы, различающиеся только числом нейтронов в ядрах, называются изотопами химического элемента.
Атом с определенным числом протонов и нейтронов в составе ядра называется нуклидом. Состав ядра задается числами Z и A. Об изотопе говорят только имея ввиду принадлежность к химическому элементу, например, 235U есть изотоп урана, но 235U – делящийся нуклид, а не делящийся изотоп.
Атомы, ядра которых содержат одинаковое число нейтронов, но разное число протонов, называются изотонами. Атомы с одинаковыми массовыми числами, но различным протон-нейтронным составом ядер, называются изобарами.
Дата добавления: 2015-06-17; просмотров: 1636;
