МАССА ЯДРА И ЭНЕРГИЯ СВЯЗИ
Масса частиц в связанном состоянии. Массу атомного ядра образуют массы нуклонов. Однако масса ядра меньше суммарной массы составляющих ядро нуклонов, поскольку нуклоны находятся в связанном состоянии. Возникновение связанного состояния возможно только под действием сил притяжения, удерживающих частицы в ограниченном объеме. Работа сил притяжения вызывает переход системы частиц в состояние с меньшей энергией покоя, сопровождающийся передачей эквивалентного количества свободной энергии другим телам или ее излучением во внешнее пространство. В дальнейшем устойчивость связанного состояния обеспечивается относительным минимумом энергии системы или ее энергией связи, равной потерянной энергии. Обратный процесс разделения системы связанной системы на составные части возможен только при при внешнем воздействии и получении извне такого количества энергии, которого недостает для того, чтобы произвести работу против сил притяжения, удерживающих частицы в связанном состоянии. Поэтому ядра, состоящие из нуклонов, атомы, состоящие из ядер и электронов, молекулы, состоящие из атомов, имеют меньшие энергии покоя, т.е. меньшие массы, чем суммарные массы составляющих их частиц в свободном состоянии.
Из вышесказанного следует, что получение свободной энергии возможно только при образовании связанных состояний частиц в тех или иных процессах, например, в ядерных и химических реакциях за счет уменьшения массы частиц. Количество освобождаемой при этом энергии 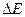 связано с убылью массы
связано с убылью массы 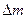 соотношением:
соотношением:
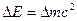 (2.7)
(2.7)
Хотя это соотношение универсально, фактически на опыте оно было проверено только для масс атомных ядер. Измерение освобождающейся энергии 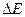 обычно не вызывает трудностей. Зато измерение
обычно не вызывает трудностей. Зато измерение 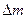 возможно лишь тогда, когда
возможно лишь тогда, когда 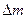 составляет заметную долю масс свободных частиц, а это зависит как от масс частиц, так и от масштаба сил, обеспечивающих связь частиц. Например, электрические силы на расстояниях между элементарными зарядами порядка 10-8 см, что характерно для молекул, относительно слабы, и соответствующие им энергии химической связи
составляет заметную долю масс свободных частиц, а это зависит как от масс частиц, так и от масштаба сил, обеспечивающих связь частиц. Например, электрические силы на расстояниях между элементарными зарядами порядка 10-8 см, что характерно для молекул, относительно слабы, и соответствующие им энергии химической связи 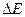 настолько малы, что никакими существующими методами невозможно обнаружить изменение масс молекул по сравнению с массами составляющих их атомов в свободном состоянии. Напротив, ядерные силы очень велики, а соответствующие им энергии связи в расчете на одну частицу по крайней мере в 106 раз превосходят энергии молекулярных связей. В этом случае убыль массы при образовании связанных состояний оказывается чуть меньше 1% массы частиц в свободном состоянии и может быть надежно зарегистрирована на опыте.
настолько малы, что никакими существующими методами невозможно обнаружить изменение масс молекул по сравнению с массами составляющих их атомов в свободном состоянии. Напротив, ядерные силы очень велики, а соответствующие им энергии связи в расчете на одну частицу по крайней мере в 106 раз превосходят энергии молекулярных связей. В этом случае убыль массы при образовании связанных состояний оказывается чуть меньше 1% массы частиц в свободном состоянии и может быть надежно зарегистрирована на опыте.
Масса ядра и масса атома. В ядерной физике обычно пользуются не массами ядер, а массами нейтральных атомов. Это объясняется невозможностью измерения масс ядер без связанных с ними электронов практически всех атомов, исключая самые легкие. Обычно ионизация атомов сопровождается отделением одного или нескольких электронов. При ядерных реакциях также образуются низкоионизованные атомы, а не их ядра. Даже при делении тяжелых ядер, когда два вновь образовавшихся ядра с большой скоростью покидают объем исходного атома, они уносят более половины атомных электронов.
В пределах точности существующих методов измерения масса нейтрального атома равна сумме массы ядра и электронов, составляющих атом, хотя в принципе масса атома должна определяться из соотношения:
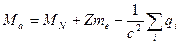 , (2.8)
, (2.8)
где 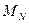 и
и 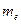 - массы ядра и электрона;
- массы ядра и электрона;
Z – число атомных электронов;
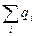 - энергия связи ядра и электронов, называемая энергией связи электронов.
- энергия связи ядра и электронов, называемая энергией связи электронов.
Значения qi хорошо известны для всех электронов любого атома и равны:
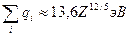 (2.9)
(2.9)
Однако, величина 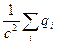 пренебрежимо мала по сравнению с
пренебрежимо мала по сравнению с 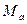 и практически не влияет на массу атома.
и практически не влияет на массу атома.
Таким образом, масса ядра с большой точностью равна разности между массой атома и массой атомных электронов. Число атомных электронов всегда известно, так как оно равно заряду ядра, поэтому обращение с массами нейтральных атомов не вызывает никаких неудобств в ядерной физике.
Массовая единица. Массы атомов измеряются в относительных единицах или атомных массах. Единицей атомной массы mu является 1/12 массы нуклида 12С. Ее абсолютное значение равно:
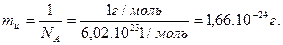 (2.10)
(2.10)
Энергетический эквивалент единицы атомной массы равен:
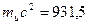 МэВ (2.11)
МэВ (2.11)
Принятие шкалы 12С для атомных масс положило конец существованию химической и физической единиц атомной массы. Тем не менее химические массы отличаются от физических, поскольку химические относятся к естественной смеси изотопов элемента, а физические – всегда атомные массы отдельных нуклидов. Химические атомные массы могут быть получены из атомных масс нуклидов с учетом распространенности в природе изотопов элемента.
Дата добавления: 2015-06-17; просмотров: 909;
