Относительная прочность клинкерных минералов
| Минерал | Прочность в относительных единицах | ||||
| 1 сут | 7 сут | 28 сут | 6 мес | 2 года | |
| 3СаО × SiO2 | 0,22 | 0,83 | 1,0 | 1,37 | 1,59 |
| 2СаО × SiO2 | - | 0,02 | 0,13 | 1,06 | 2,02 |
| 3СаО × Al2O3 | 0,03 | 0,04 | 0,08 | 0,12 | 0,11 |
| 4СаО × Al2O3 · Fe2O3 | - | 0,04 | 0,05 | 0,08 | 0,10 |
За единицу прочности принята прочность С3S в возрасте 28 сут.
Исходя из данных табл. 3.4, вытекает вывод о перспективности цементного клинкера, в котором преобладала бы белитовая фаза при условии повышения ее гидравлической активности в ранние сроки. Решение этой актуальной проблемы производства белитового цемента позволит:
- снизить расход топлива на 55-90 ккал/кг;
- уменьшить удельный расход сырьевых материалов за счет снижения содержания в сырьевой смеси СаСО3;
- вследствие более низкой температуры обжига увеличить компанию печи;
- сократить размеры вращающейся печи на 15%;
- более полно использовать минеральное сырье, в частности карбонатное, с низким содержанием СаСО3;
- снизить эмиссию NOх в связи с меньшим количеством сжигаемого топлива.
Трехкальциевый алюминат, так же как и 3СаО · SiO2 и 2СаО · SiO2, способен образовывать твердые растворы. Содержание этой фазы в клинкерах составляет 5-8 мас. % и существует в клинкере только в виде твердого раствора.
3CaO · Al2O3 является одним из важнейших соединений в системе СаО - Al2O3 (рис. 3.4), плавится инконгруэнтно при 1542°С с образованием СаО и жидкой фазы.
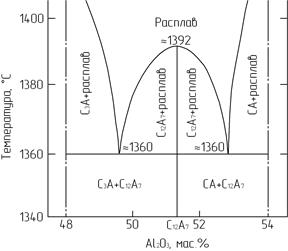
Рис. 3.4. Фрагмент высокоосновной области
диаграммы состояния СаО - Al2O3
Кристаллы чистого С3А имеют кубическую сингонию. Эта фаза является важной составляющей клинкера, существенно влияющей на скорость схватывания, прочность на ранней стадии твердения, тепловыделение. Кристаллическая решетка С3А слагается симметрично расположенными многогранниками (AlO4), (AlO6), (CaO6), (CaO12). Тетраэдрические и октаэдрические многогранники соединяются в кристаллической решетке только вершинами, образуя бесконечные цепочки - Са - О - Са - О и О - Al - O - Al - O, а также и связи в цепи - О - Са - О - Al - О -. В этом каркасе имеются пустоты, в которые могут внедряться различные катионы. Образование твердых растворов может протекать по схеме гетеровалентного изоморфизма следующим образом:
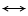 Са2+ + Al3+ Na+ (K+) + Si4+.
Са2+ + Al3+ Na+ (K+) + Si4+.
Октаэдрические позиции катионов Al3+ могут замещаться ионами Fe3+. Вхождение в решетку С3А оксидов натрия и калия (1,4%) взамен Са2+ приводит к стабилизации кубической формы. Большее содержание Na2O (до 3,7%) приводит к образованию смеси кубической и ромбической модификации. Увеличение содержания Na2O до 4,6% приводит к образованию орторомбической решетки, а повышение концентрации до 7,5% формирует моноклинную, являющуюся искаженной первой. Эти процессы можно представить следующей схемой:
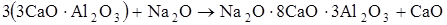 .
.
Состав алюминатной фазы в клинкере находится в следующих пределах (мас. %):
CaO - 48,10-61,20; Na2O - 1,10-2,25;
Al2O3 - 21,65-34,20; K2O - 1,40-3,85;
SiO2 - 3,67-6,60; MgO - 0,55-1,15;
Fe2O3 - 4,30-6,60; TiO2 - 0,03-0,40.
Кристаллы С3А прямоугольной формы имеют размеры 10-50 мкм. Как чистый С3А, так и твердые растворы на его основе мгновенно схватываются при затворении водой, что сопровождается большим тепловыделением и даже образованием пара. Для предотвращения такого явления в цемент вводят CaSO4 · 2H2O, который обеспечивает нормальные сроки схватывания.
Высокое содержание С3А в цементах негативно влияет на сульфатостойкость бетонов. Цементы для гидротехнических морских сооружений не должны содержать С3А более 5%.
Алюмоферритная фаза клинкера представляет собой ряд твердых растворов в системе CaO - Al2O3 - Fe2O3. Эта фаза вместе с твердыми растворами на основе С3А составляет так называемую промежуточную фазу клинкера. Твердые растворы алюмоферритов образуются вследствие изоморфного замещения в двухкальциевом феррите 2СаО · Fe2O3 атомов Fe3+ на Al3+. В бинарной системе СаО - Fe2O3 известны три соединения: 2СаО · Fe2O3 (С2F); СаО · Fe2O3 (СF); СаО · 2Fe2O3 (СF2) (рис. 3.5).
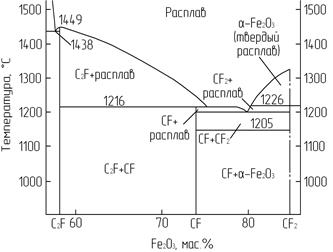
Рис. 3.5. Фрагмент диаграммы состояния
системы СаО - Fe2O3
Равновесие фаз в этой системе неустойчиво из-за потери кислорода при высоких температурах. Моноферрит кальция (СаО · Fe2O3) разлагается при 1216°С с образованием СаО · 2Fe2O3 и жидкости, который плавится инконгруэнтно при 1226°С. Двухкальциевый феррит характеризуется конгруэнтным плавлением при 1438°С. Эти фазы в клинкерах не обнаруживаются. Алюмоферритная фаза в цементном клинкере чаще всего представляется как браунмиллерит 4СаО · Al2O3 · Fe2O3, которая слагается из октаэдров [FeO6]9- и [AlO6]9- и тетраэдров [FeO4]5- и [AlO4]5-.
Браунмиллерит способен включать в свой состав ряд примесных катионов, в результате чего твердый раствор на базе С4АF в реальных клинкерах имеет следующий состав (мас. %):
CaO - 45,95-51,75; Na2O - 0,05-0,20;
Al2O3 - 13,70-23,16; K2O - 0,05-0,85;
Fe2O3 - 18,67-30,63; MgO - 1,60-3,30;
SiO2 - 2,50-4,55; TiO2 - 0,40-1,73.
Минерал С4АF быстро гидратируется и подобно С3А приобретает небольшую прочность. Тепловыделение в этом случае значительно меньше, чем в случае с С3А. В процессе спекания клинкера С4АF наряду с С3А выполняет роль плавня, интенсифицируя процесс связывания СаО с SiO2 с образованием силикатов кальция.
Увеличение содержания С4АF при одновременном снижении количества С3А в цементах обеспечивает бетонам на их основе повышенную сульфатостойкость.
Второстепенные клинкерные фазы. К ним относятся все, кроме четырех вышеописанных.
Свободный СаО имеет двоякое происхождение: неусвоенный кислотными оксидами при обжиге и как фаза, выделившаяся при разложении С3S и С3А при охлаждении, либо под влиянием примесей и газовой среды печи.
В первом случае оксид кальция, пройдя высокотемпературную зону печи, формируется в виде крупных кристаллов (до 100 мкм); во втором случае СаО находится в клинкере в виде мелких зерен, включенных в матричную фазу, и поэтому его количественное определение затруднено по сравнению с первым случаем.
При содержании свободного СаО свыше 1-1,5% может произойти неравномерное изменение объема из-за поздней (уже в изделиях) его гидратации, сопровождающейся увеличением объема в 2-3,5 раза. Это нежелательное явление вызвано тем, что при температуре 1400-1450°С происходит рекристаллизация кристаллов СаО, залечивание дефектов на их поверхности и потеря реакционной способности.
Оксид магния растворяется в клинкерном расплаве в незначительном количестве (~ 6-8%). В процессе кристаллизации алита часть ионов Mg2+ внедряется в его структуру, остальное количество MgO интенсивно перекристаллизовывается и образует крупные правильные кристаллы периклаза. В зоне охлаждения оксид магния входит в состав твердого раствора на основе С4AF. Таким образом, в составе алита может находиться 1-1,5 мас. % MgO, в алюмоферритах ~ 0,7%. Наибольшую опасность для бетонов представляет крупнокристаллический MgO, который гидратируется в течение нескольких лет, так же как и пережженный СаО с увеличением объема. По этой причине содержание MgO в клинкерах ограничивается 5 мас. %.
Неусвоенный (несвязанный) SiO2 может оставаться в клинкере, если в исходном сырье свободный кварц присутствовал в виде зерен размером более 0,2 мм. Эта фаза в клинкере является балластом и в бетоне по существу будет выполнять роль мелкого заполнителя.
Стеклофаза образуется при резком охлаждении клинкерного расплава. Она как бы склеивает клинкерные минералы в конгломерат. Количество стеклофазы окажет влияние на размалываемость клинкера при помоле цемента, а также на количество теплоты, выделяющейся при его гидратации. В небольших количествах в клинкерах могут присутствовать CaSO4, щелочесодержащие минералы состава NC8A3, KC23S12, KC8A3, а также FeO и даже металлическое железо.
Дата добавления: 2015-06-17; просмотров: 2676;
