ЛИНЕЙЧАТЫЙ СПЕКТР. ПОСТУЛАТЫ БОРА И КВАНТОВАНИЕ ОРБИТ
Если металл нагреть до температуры испарения, то его пар начинает светиться, причем пар каждого металла имеет свой цвет. Разложенное стеклянной призмой излучение пара металла образует спектр, состоящий из отдельных линий. Такой спектр называется линейчатым (рис.173).
Рис. 173
Каждая линия спектра характеризуется определенной длиной волны или определенной частотой электромагнитного излучения. Длины волн в настоящее время измеряются в ангстремах )1А=10-8см) или нанометрах (1нм=10-9м). В 1905г. Эйнштен высказал предположение, которое нашло в дальнейшем экспериментальное подтверждение о том, что свет распространяется в виде фотонов, энергия которых Е связана с длиной волны света λ и частотой ν соотношением
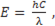 (13-1)
(13-1)
где с скорость света (с=3 1010см/c), h- постоянная Планка (6,63 10-34Дж с)
Таким образом, каждую линию линейчатого спектра создают фотоны с одинаковой энергией. Следовательно, атомы излучают энергию в виде фотонов или квантов энергии, которые для каждого вида атомов имеют вполне определенные значения.
Успех в устранении этих противоречий был достигнут Нильсом Бором в 1913 г., когда он распространил идеи Планка и Эйнштейна о квантовых свойствах электромагнитного излучения и на атомы вещества. Бор ограничился рассмотрением атома водорода, поскольку он очень прост (единственный электрон вращается вокруг одного протона) и поддается математическому анализу. Изучая линейчатый спектр атома, Бор понял, что существуют очень простые правила, управляющие излучением световых волн атомами вещества, которые хорошо объясняют множество существующих электронных орбит. Свои выводы он сформулировал в виде известных постулатов Бора.
Первый постулат Бора (постулат стационарных состояний): электроны в атоме могут обладать лишь определенными (разрешенными) значениями энергии, другими словами _ находиться на определенных энергетических уровнях, образующих дискретный энергетический спектр атома.
Второй постулат Бора (правило частот): при определенных условиях электроны могут переходить с одного уровня на другой (или с одной орбиты на другую), поглощая или испуская фотон (рис.174). Существует орбита с наименьшей возможной энергией, на которой электрон может находиться неограниченно долго -это его основное состояние. При переходе с низшего энергетического уровня на высший электрон возбуждается, но при каждом удобном случае всегда стремиться вернуться из возбужденного состояния обратно в основное. В возбужденном состоянии электрон может находиться не дольше наносекунды. Что же заставляет электрон постоянно стремиться к своему первоначальному состоянию? Большинство всех объектов в природе всегда стремится минимизировать любое механическое напряжение. Так, например, капля жидкости принимает сферическую, а не треугольную или квадратную форму именно потому, что такая форма наиболее “выгодна” с точки зрения противостояния силам поверхностного натяжения. Тоже самое справедливо и для электрона: чтобы удержаться на верхней орбитали (превосходящей по энергии его собственную), ему нужно изрядно “попотеть”, преодолевая мощную силу притяжения ядра – а какому нормальному электрону это понравится? В этом смысле электрон можно в шутку сравнить с лентяем в спортзале: едва тренеру удастся загнать его на высокую перекладину, он вместо того, чтобы подтягиваться, тут же норовит c нее спрыгнуть. “А как же тогда электрон переходит на более высокий уровень?”, – спросите вы. Предположим, что атом находится в состоянии n и обладает энергией En . Чтобы вынудить электрон перейти на уровень m, мы должны каким -то образом “выпихнуть” его из основного состояния, придав ему некоторую дополнительную энергию (подобно тому, как пинок тренера необходим, для того, чтобы лодырь оказался на перекладине). Для этого будем “обстреливать” электрон световыми фотонами различной частоты
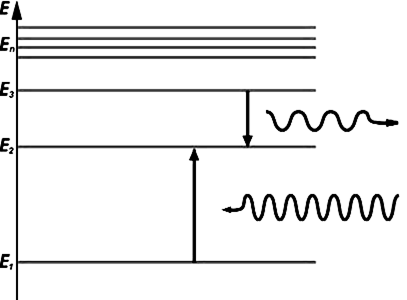
Рис. 174 Энергетическая схема атомных уровней.
Энергия Е1 соответствует основному состоянию, Е2 – возбужденному. Напоминаем, что энергия фотона зависит от частоты излучения, поэтому она равна: Е=hν , где ν–частота, h–постоянная Планка. Оказывается, не каждый фотон способен вынудить атом перейти в возбужденное состояние, а лишь тот, чья энергия в точности равна разности энергий возбужденного и основного состояний электрона в атоме, то есть: hν=Еm-En (рис.175). Только при такой энергии электрон, поглотив фотон, перейдет на уровень, соответствующий энергии Еm.
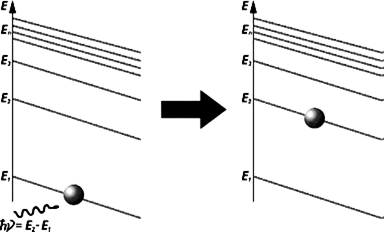
Рис.175 Получив необходимое количество энергии, электрон переходит на следующий
энергетический уровень.
Если же энергия фотона окажется больше либо меньше необходимой, то он “пролетит” сквозь атом, никоим образом не повлияв на состояние электрона. Итак, электрон находится в возбужденном состоянии, из которого он в силу своей природы стремится вернуться обратно на “родной” уровень. Для этого ему нужно “освободиться” от энергии, полученной от фотона. Поэтому обратный переход сопровождается испусканием светового фотона абсолютно той же частоты, то есть
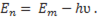 (13-2)
(13-2)
Так квантовая механика обнаружила, что атом обладает способностью поглощать и испускать фотоны света, и это в дальнейшем послужило основой создания лазеров и множества других машин, использующих этот принцип. Итак, сформулируем важный вывод из теории квантовой механики: физические величины в квантовом мире изменяются квантами, т.е. дискретно. Невозможно представить себе квантовую физику без одного из ее основных принципов: Строго говоря, орбита в квантовой механике – понятие довольно условное. Из-за несовершенства современной аппаратуры и невозможности четко зафиксировать положение электрона в атоме, можно лишь приблизительно говорить о некоторой “размытой” орбите электрона, означающей только то, что “в среднем” электрон находится на определенном расстоянии от ядра.
Дата добавления: 2015-06-17; просмотров: 2118;
