ЭЛЕКТРОХИМИЧЕСКИЕ ГЕНЕРАТОРЫ
Химический источник тока (генератор) – это устройство, в котором химическая энергия напрямую превращается в электрическую. Основой работы химического генератора является химическая реакция взаимодействия окислителя и восстановителя. В процессе взаимодействия окислитель восстанавливаясь присоединяет электроны, а восстановитель, окисляясь отдает электроны.
Рассмотрим явления, происходящие при опускании цинкового (Zn) электрода в раствор сернокислого цинка (ZnSO4). Молекулы воды (H2O) стремятся окружить положительные ионы цинка в металле (см. рис.163). В результате действия электростатических сил положительные
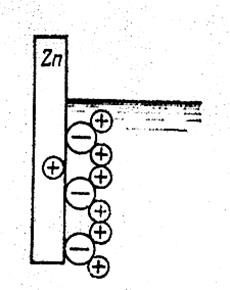
Рис. 163 Расположение электрических зарядов вблизи цинкового электрода.
ионы цинка переходят в раствор сернокислого цинка. Этому переходу способствует большой дипольный момент молекул воды. По мере перехода положительных ионов металла в раствор появляется и увеличивается отрицательный потенциал на цинковом электроде, препятствующий дальнейшему растворению цинкового электрода. При некотором потенциале электрода наступает динамическое равновесие, т.е. два встречных потока ионов ( от электрода в раствор и обратно) становятся одинаковыми. Этот потенциал называют электрохимическим потенциалом металла относительно данного электролита.
1. Анод представляет собой цилиндр из цинка (Zn) , который служит оболочкой элемента.
2. Катод - графитовый стержень.
3. Активная масса (прессованная), содержит диоксид марганца (MnO2 + графитовая сажа +NH4Cl (хлорид аммония). Вся эта активная масса обернута полотном и перевязана ниткой.
4. Пространство между внутренней и наружной стенками цилиндра заполнено электролитической массой из муки и клееобразующих веществ + раствор NH4Cl + цинковый порошок.
Сверху элемент заливается смолой для герметизации.
Напряжение порядка 1,5В.
Основным окислительно-восстановительным процессом является химическая реакция
Zn + 2NH4Cl + 2MnO2→Zn (NH4)2Cl2 + Mn2O3 + H2O
т.е. работа элемента связана с растворением цинка и восстановлением диоксида марганца.
В конструкции сухого элемента отсутствуют жидкости и хрупкие стеклянные части. Со временем разрушается только цинковая оболочка.
Каждый окислительно-восстановительный процесс имеет начало и конец. Отработав определенное время, элемент истощается и его напряжение падает, один из электродов полностью растворяется. Например, растворяется цинковая оболочка и часть электролитной пасты может просочиться наружу.
Использовать в дальнейшем сухой элемент нельзя, хотя в нем еще есть металлы, соли, окислы и другие составные части.
Примером другой химической реакции является взаимодействие диоксида свинца (PbO2) и свинца в свинцовом аккумуляторе (применяемом в автомобилях), заполненном электролитом (25-30% водный раствор серной кислоты (H2SO4). При этом важным моментом является пространственное разделение процессов окисления и восстановления. Для этого создаются два электрода различной природы, погруженные в электролит. Электродами называют электронные проводники, имеющие вывод в аккумуляторе и контактирующие с электролитом.
Рассмотрим явления, происходящие при опускании свинцового (Pb) электрода в раствор серной кислоты (H2SO4) (рис.164). Ионы SO4 -2 стремятся окружить положительные ионы свинца в металле В результате действия электростатических сил положительные ионы свинца переходят в раствор серной кислоты. Этому переходу способствует большой дипольный момент иона SO42-. По мере перехода положительных ионов металла в раствор появляется и увеличивается отрицательный потенциал на свинцовом электроде, препятствующий дальнейшему растворению свинцового электрода. При некотором потенциале электрода наступает динамическое равновесие, т.е. два встречных потока ионов ( от электрода в раствор и обратно) становятся одинаковыми. Этот потенциал называют электрохимическим потенциалом металла относительно данного электролита.
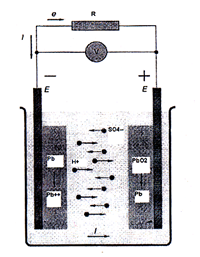
Рис.164 Схема гальванического элемента.
На отрицательном электроде окисляется свинец
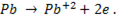
Ион свинца переходит в электролит, взаимодействует с ионом SO4 и осаждается на аноде в виде малорастворимого сульфата свинца PbSO4 .
На положительном полюсе восстанавливается диоксид свинца по схеме
PbO2 + 4H+ + 2e→ Pb2+ +2H2O
И образующиеся ионы Pb2+ осаждаются на поверхности катода в виде PbSO4.
Суммарной реакцией является реакция типа
Pb +PbO2 + 4Н+ +2SO42- → 2PbSO4 + 2H2O
В данной реакции восстановителем является - свободный металл, а окислителем - ионы четырехвалентного свинца Pb+4, входящие в состав диоксида свинца. Они обмениваются между собой электронами и образуются ионы двухвалентного свинца Pb+2. Различие в электродном материале, а значит и разность электродных потенциалов постепенно уменьшаются. Если этот процесс будет идти до конца, она исчезает совсем. Но этого мы не допустим. После работы в течение определенного времени аккумулятор надо зарядить.
При зарядке он играет роль потребителя электрической энергии. Подключим его к клеммам выпрямителя тока и заставим те же самые процессы протекать в обратном направлении. На одном электроде восстанавливается свинец с нулевой валентностью (металл), а на другом - четырехвалентный.
Свинцовый аккумулятор прост в эксплуатации и обладает устойчивым режимом работы. Его напряжение 2В. Конструируют аккумуляторные батареи, содержащие 2, 4, 6, 8 и более ячеек. Такие батареи используют в двигателях внутреннего сгорания, электромобилях и т.д. Удобно работать с такими батареями. Нет ни дыма, ни выхлопных газов.
Дата добавления: 2015-06-17; просмотров: 998;
