Одноклеточные формы с более мелкими клетками.
Такие микроорганизмы объединяют в два рода — Thiospira и Thiobacterium.
Представители Thiospira изучены очень мало, хотя описано несколько видов (Т. winogradskyi, Т. bipunctata, T. elongata, T. undula). Все они имеют извитую форму клеток со жгутиками. Наиболее крупным видом является Т. winogradskyi. Размеры этой бактерии составляют 2,0—3,5 х 3,5—5,0 мкм.
Род Thiobacterium включает три вида — Т. bovista, T. cristallyferum, T. retiformans. Это неподвижные мелкие палочки, окруженные слизистыми капсулами; способны образовывать зооглеи. Отложение серы в клетках обнаружено только у Т. bovista.
По морфологии, характеру движения, способу размножения и строению клеток ряд представителей бесцветных серобактерий, как многоклеточные, так и одноклеточные (Beggiatoa, Thiothrix, Thiospirillopsis, Thioploca, Achromatium) проявляют большое сходство с сине-зелеными водорослями. Некоторые исследователи, в частности Прингсхейм (Pringsheim, 1963), рассматривают эти микроорганизмы как бесцветные их варианты. Аналогом Beggiatoa считают сине-зеленую водоросль Oscillato-ria, Thiothrix — Rivularia, Thiospirillopsis — Spirulina, a Achromatium похож на Synecho-coccus. Поскольку сине-зеленые водоросли сейчас причисляют к бактериям, то их сближение с бесцветными серобактериями становится все более обоснованным. Следует также отметить, что у некоторых сине-зеленых водорослей обнаружена способность откладывать в клетках серу, хотя один этот признак мало что дает для систематики микроорганизмов.
Микроорганизмы, относящиеся к бесцветным серобактериям, встречаются и в пресных и в соленых водоемах. Некоторые из них хорошо растут при низкой температуре, другие (Thios-pirillum pistiense) развиваются в термальных серных источниках при температуре более 50 °С. Бесцветные серобактерии аэробы. Подвижные формы обладают хемотаксисом и могут перемещаться в места с оптимальным содержанием кислорода и сероводорода. Еще С. Н. Виноградский отметил (1887 —1889), что бесцветные серобактерии могут расти в воде, содержащей очень небольшие количества органических веществ, и предполагал поэтому, что они способны усваивать углекислоту. Однако на минеральной среде, содержащей сероводород, удалось выращивать пока в виде чистых культур только Thiovulum majus и некоторые штаммы Beggiatoa. Другие представители микроорганизмов, определенные как Beggiatoa, оказались способными развиваться только на органических средах, содержащих сенной отвар, пептон, мясной экстракт, аминокислоты или ацетат. Некоторые проявили потребность в витамине В12. Добавление ацетата и других органических соединений также улучшало рост штаммов Beggiatoa, развивающихся на минеральных средах. При наличии ацетата в клетках отмечалось появление гранул поли-бета-оксибутирата. На основании изучения физиологии разных штаммов Beggiatoa Прингсхейм считает, что среди них есть автотрофы, окисляющие сероводород и фиксирующие С02, и есть представители, нуждающиеся в органических соединениях. Но и ряд гетеротрофных штаммов Beggiatoa в присутствии органических соединений окисляет сероводород, возможно, с получением энергии, т. е. они являются хемолитоге-теротрофами. Однако биология этих микроорганизмов, а еще в большей степени других бесцветных серобактерий исследована мало. Особенно заслуживает внимания вопрос о роли сероводорода в их метаболизме.
Наряду с бесцветными серобактериями известны типичные гетеротрофные микроорганизмы, участвующие в окислении сероводорода, молекулярной серы и тиосульфата. К числу таковых относятся представители Bacillus, Pseudomonas, Achromobacter, Sphaerotilus,, а также актиномицетов, плесневых грибов (Penicilliurn luteum, Aspergillus niger), дрожжей и Alternaria. Некоторые из них, в частности нитчатая многоклеточная бактерия Sphaerotilus natans, в присутствии сероводорода откладывает в клетках серу. Другие (Pseudomonas aeruginosa, Ps. fluorescens, Achromobacter stuzeri) способны окислять тиосульфат до тетратионата (NaaS406). Отмечено также образование политионатов и сульфата при воздействии смешанных культур гетеротрофных микроорганизмов на элементарную серу. Механизм окисления и биологическое значение этого процесса для гетеротрофов остаются не выясненными.
Сероводород и другие соединения серы окисляют большинство фототрофных бактерий, причем многие из них являются автотрофами. Для этих микроорганизмов восстановленные соединения серы служат Н-донорами при ассимиляции углекислоты и в других процессах, а источником энергии является свет. В отличие от этого большинство так называемых тионо-вых бактерий — типичные хемоавтотрофы, т. е. они используют восстановленные соединения серы не только как Н-доноры, но и в качестве источников энергии и способны расти на чисто минеральных средах, ассимилируя углекислоту. Такие бактерии были впервые выделены из воды Неаполитанского залива (Натансон, 1902) и получили название Thiobacillus (Бейеринк, 1904). К настоящему времени описано много видов автотрофных тиобацилл, выделенных из разных водоемов, почвы, а также из месторождений серы и разных металлов.
На основании некоторых, главным образом физиологических, особенностей (способность окислять различные соединения серы и другие неорганические субстраты, использовать органические соединения, расти в зависимости от значений рН среды, отношение к кислороду и др.) выделяют значительное число видов тиобацилл. Из них считаются наиболее твердо установленными следующие: Thiobacillus thioparus, Т. thiooxidans, Т. denitrificans, Т. thiocyano-xidans, Т. neapolitanus, T. intermedius, Т. novellus, T. ferrooxidanas. Все эти микроорганизмы растут на простых минеральных средах, куда часто вносят бикарбонат. Источником азота обычно служат соли аммония. Некоторые виды и штаммы способны ассимилировать как источники азота нитраты. Показана также способность отдельных представителей использовать мочевину и аминокислоты. Штаммы, выделенные из соленых водоемов, требуют для роста хлористого натрия, причем известны га-лофилы, способные расти в насыщенном растворе NaCl. Оптимальная температура для роста большинства выделенных микроорганизмов рода Thiobacillus около 30 °С. Однако в природных условиях они встречаются в термальных источниках при температуре до 55 °С. Недавно выделена чистая культура Thiobacillus sp. с оптимумом для роста при 50 °С.
По отношению к кислотности среды тиоба-циллы подразделяются на организмы, хорошо растущие при нейтральной или даже щелочной реакции, и виды, являющиеся ацидофильными, т. е. развивающиеся в кислой среде и выдерживающие очень низкое значение рН.
К первой группе относятся такие виды, как: Т. thioparus, T. denitrificans, T. novellus, Т. thiocyanoxidans, T. neapolitanus. Для этих микроорганизмов оптимальное значение рН приходится на область 6,0—9,0, а зона значений рН, при которых возможен их рост,— от 3,0—6,0 до 10,0—11,0, причем для разных видов и штаммов оптимальные значения рН и область активной кислотности, в которой наблюдается их рост, могут заметно различаться.
Ко второй группе принадлежат Т. thiooxidans, Т. ferroxidans, T. intermedius. Для этих микроорганизмов оптимальное значение рН 2,0—4,0, а рост возможен при рН от 0,5 — 2,0 до 5,0—7,0. Наиболее ацидофильными организмами являются два первых вида. Обе эти бактерии растут при значениях рН не более 5,0. В то же время показано, что Т. thiooxidans сохраняет жизнеспособность при значении рН, близком к 0, что соответствует 1,0 п. раствору серной кислоты. Это, пожалуй, самый ацидофильный микроорганизм, который известен исследователям.
Большинство тионовых бактерий растет только в присутствии кислорода, хотя рост некоторых представителей возможен при низком его содержании. Но известны и факультативные анаэробы. К ним относится Т. denitrificans. В аэробных условиях эти бактерии ведут окислительные процессы с участием молекулярного кислорода, в анаэробных переключаются на денитрификацию и восстанавливают нитраты до молекулярного азота. Интересно отметить, что ассимилировать нитраты как источники азота Т. denitrificans, подобно Paracoccus denitrificans, не может и требует для роста в качестве источника азота аммония.
Тионовые бактерии способны окислять такие соединения серы, как сероводород, сульфиды, сульфит, тиосульфат, тетратионат, тиоцианат (роданид), дитионит, а также молекулярную серу, с образованием при полном их окислении сульфатов. Однако способности отдельных видов не вполне одинаковы. Кроме того, не всегда легко установить, какие именно соединения серы окисляются биологическим путем, так как многие из них неустойчивы при низком значении рН и могут также окисляться кислородом воздуха.
Все виды, растущие при нейтральной и щелочной реакции среды, как правило, окисляют сероводород, серу и тиосульфат. Характерным признаком Т. thiocyanoxidans является способность окислять роданид. На этом основании его выделяют в отдельный вид, так как по другим признакам этот микроорганизм похож на Т. thioparus. Такую ацидофильную бактерию, как Т. thiooxidans, культивируют обычно на среде, содержащей молекулярную серу. Вопрос о способности данного вида окислять сероводород и другие соединения серы окончательно не решен, так как в кислых условиях эти соединения неустойчивы. В отношении Т. fer-roxidans есть данные, что эти бактерии могут окислять как молекулярную серу, так и различные ее соединения, а именно: сероводород, тиосульфат, дитионит, тетрасульфат, сульфит. Кроме того, Т. ferroxidans активно участвует в окислении сульфидов тяжелых металлов, которые нерастворимы в воде. К ним относятся такие минералы, как пирит (FeS2), халькопирит (CuFeSz), антимонит (SbS2), халькозин (Сu2S), кавеллин (CuS), пирротин (FeS), реальгар (AsS), виоларит (Ni2FeS4) и др. Остальные тио-новые бактерии или такой возможностью не обладают, или она выражена слабо.
Отличительным свойством Т. ferroxidans является также способность окислять закисное железо в окисное. На этом основании данные бактерии могут рассматриваться как железобактерии, хотя относятся к роду Thiobacillus.
Как уже отмечалось выше, конечным продуктом окисления тионовыми бактериями молекулярной серы и различных ее соединений является сульфат. Если процесс идет таким образом, т. е. происходит полное окисление исходного субстрата, то результаты его отражают следующие уравнения. При окислении сероводорода:
H2S+1/202->Н2О+S0 ; дельта F = -17,2*104 дж.
При окислении серы и тиосульфата в аэробных условиях:
S0+1/2О2+Н20 -> Н2S04, делта F = - 49,8104 дж,
S2032- + 202 + H20 -> 2S042- + 2H+,
дельта F = — 88,6*10 4 дж.
При окислении серы и тиосульфата Т. denitri-ficans в анаэробных условиях за счет использования нитратов:
5S+6KN03+4NaHCO3 -> 2Na2S04+3K2S04+2C02+3N2
5Na2S203+8KN03+2NaHC02 -> 6Na2S04+4K2S04+4N,+C02+H20,
дельта F = — 75,2*104 дж.
При окислении Т. thiocyanoxidans роданида:
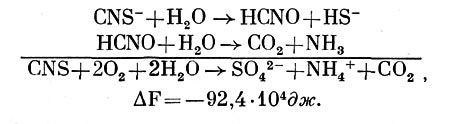
Однако нередко окисление идет не до конца, и в среде обнаруживаются различные не полностью окисленные продукты. Так при окислении сероводорода иногда появляется молекулярная сера, обнаружены также тиосульфат и политионаты. При окислении бактериями молекулярной серы констатировали появление тиосульфата и политионатов. Окисление тиосульфата также часто сопровождается образованием политионатов (тритионата, тетратионата, пентатионата) и элементарной серы. К числу не полностью окисленных продуктов относится и сульфит. Но не все из этих соединений могут являться результатом ферментативных процессов и действительно относятся к промежуточным продуктам окисления бактериями исходного субстрата. Некоторые из них образуются, видимо, чисто химическим путем или в результате побочных биологических реакций. Поэтому выяснение путей окисления микроорганизмами различных соединений серы весьма сложно, и далеко не все реакции до сих пор выяснено.
Очень мало еще данных о природе первого этапа превращения сульфида и не выяснено до конца, является сера прямым или побочным продуктом его окисления.
Весьма сложен вопрос об использовании бактериями элементарной серы, причем он имеет два аспекта: каким образом микроорганизмы воздействуют на это нерастворимое в воде вещество и как происходит сам процесс окисления.
В отношении механизма воздействия тиобацилл на серу существуют две точки зрения.
1. Для окисления бактериями серы необходим непосредственный контакт ее с клетками.
2. Сера используется бактериями после предварительного растворения в веществах липид-ной природы, выделяемых ими в среду.
При росте Т. thiooxidans на среде с молекулярной серой в среде обнаруживаются фосфолипиды. По одним данным — это фосфатидилино-зит, по другим — несколько иные соединения (фосфатидил-N-метилэтанол, фосфатидилглице-рин, дифосфатидилглицерин), причем их накопление совпадает с фазой активного роста культур. Тем не менее считать доказанным второе предположение нельзя. Вполне вероятно, что для окисления серы бактериями важен и контакт ее с клетками, и выделение ими определенных веществ, которые «смачивают» серу.
Что касается пути окисления серы, то данные также довольно разноречивы. Наиболее вероятной считается следующая схема, которая приемлема также для окисления сероводорода:
Предполагается, что X либо производное глутатиона, с которым реагирует сероводород или сера, либо тиол, связанный с мембранами клеток. Образование тиосульфата рассматривается как неферментативный процесс, который может идти без участия бактерий.
Большое число исследований посвящено изучению окисления тиосульфата. Данные опытов, проведенных с целыми клетками и бесклеточными препаратами разных видов тиобацилл, позволяют считать, что начальный этап превращения тиосульфата может быть связан либо с его восстановлением под действием редуктазы с образованием сероводорода и сульфита:

либо с расщеплением до элементарной серы и сульфита:
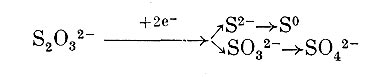
либо, наконец, с окислением до тетратионата и затем превращением в тритионат и сульфит:

Предполагают, однако, что последний путь превращения тиосульфата не является основным. Что касается расщепления тиосульфата с образованием сульфита, то такую реакцию может осуществлять родоназа, связывающая серу в виде тиоцианата:
S2032- + CN- -> S032- + CNS-
Она широко распространена не только у тионовых и других бактерий, но также у животных. Однако участвует ли этот фермент в метаболизме тиосульфата тионовыми бактериями, окончательно не установлено.
Значительно более исследован путь окисления сульфита. Работами, проведенными в лаборатории Пека с Т. thioparus, показано, что сульфит взаимодействует с аденозинмонофосфатом (АМФ), что приводит к образованию соединения, называемого аденилилсульфатом или аденозинфосфосульфатом (АФС). На следующем этапе происходит реакция между АФС и неорганическим фосфатом (Фн) с образованием аде-нознндифосфата (АДФ) и освобождением свободного сульфата:
28032-+2АМФ -> 2АФС+2е 2АФС+2Фн -> 2АДФ+2 S042-
В результате действия фермента аденилаткиназы две молекулы АДФ могут превращаться в АТФ и снова давать АМФ:
2АДФ -> АТФ + АМФ
Таким образом, данный путь окисления сульфита связан с получением энергии (АТФ) в результате так называемого субстратного фосфорилирования. В то же время процесс окисления сульфита может сопровождаться передачей электронов в дыхательную цепь, функционирование которой сопряжено с синтезом АТФ.
Для ряда тионовых бактерий, в том числе Т. thioparus, показано, что окисление сульфита возможно и без образования АФС, в результате действия сульфитокисляющего фермента, который обеспечивает передачу электронов в дыхательную цепь на уровне цитохромов:
S032-+2цит. Fe3+ + H20 -> S042- + 2цит. c Fe2+ + 2H+
Не исключено, что у одного и того же организма могут функционировать разные пути окисления сульфита и других соединений серы, и значение того или иного зависит от условий среды и других факторов. На основании имеющихся к настоящему времени данных окисление тионовымп бактериями разных соединений серы можно представить следующей обобщенной схемой (рис. 139).
Что касается компонентов электрон-транспортных систем тионовых бактерий, то, по всем данным, в состав их у разных видов всегда входят цитохромы типа с. Обнаружены также цитохромы типа Ъ и, видимо, его вариант, называемый цитохромом о, а у некоторых представителей — цитохромы а и d. Кроме того, в электрон-транспортную систему входят, видимо, флавопротеиды и убихиноны. Но дыхательная цепь тионовых бактерий, обеспечивающая передачу электронов на кислород, как и у нитрифицирующих бактерий, сравнительно короткая, так как окисляемые субстраты имеют довольно высокий окислительно-восстановительный потенциал. Поэтому для данных микроорганизмов важное значение имеет энергозависимый перенос электрона против термодинамического градиента (обратный перенос электрона). Он обеспечивает образование восстановленного НАД, необходимого для ассимиляции углекислоты и других конструктивных процессов. Следует также отметить, что компоненты электрон-транспортных систем и пути переноса электронов не только могут иметь определенные различия у разных представителей тионовых бактерий, но и зависеть от характера окисляемого субстрата. Поэтому обобщенная схема (рис. 140) весьма условна.

Рис. 139. Пути окисления соединений серы тоновыми бактериями.
По расчетам разных авторов, эффективность использования тионовыми бактериями свободной энергии составляет от 2 до 37%. Как и другие хемоавтотрофы, тионовые бактерии ассимилируют углекислоту в основном через цикл Кальвина (см. главу «Фототрофные бактерии»). Но они обладают также способностью осуществлять другие реакции карбоксилирования, которые имеют важное значение для образования некоторых метаболитов.
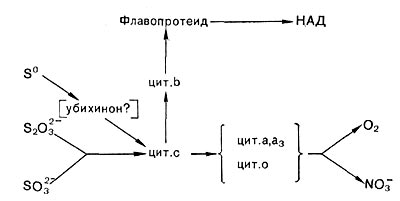
Рис. 140. Пути переноса электронов у тионовых бактерий при окислении разных соединений серы.
Разнообразно отношение тионовых бактерий к органическим соединениям. Ряд представителей этих микроорганизмов, а именно: Т. thioparus, Т. thiooxidans, T. thiocyanoxidans, Т. denitrifleans, T. neapolitanus, способны ассимилировать некоторые органические соединения, в частности ацетат, пируват, отдельные аминокислоты, включая их углерод в белки и другие компоненты клеток, но в ограниченной степени. Так, например, углерод ацетата в клетках Т. thioparus может составлять около 9%, сукцината — до 11%, а пирувата — около 2,5%. В отсутствие неорганических восстановленных соединений серы эти микроорганизмы не растут или рост их наблюдается в специфических условиях и медленный. Так, есть данные, что можно получить рост культур Т. thioparus, Т. thiooxidans, T. denitrificans, T. neapolitanus на среде с глюкозой в диализируемых культурах. Объясняют это тем, что необходимо постоянно удалять из среды продукты метаболизма глюкозы в виде кетокислот (пирувата и, возможно, других), которые ингибируют рост тиобацилл.
Такой организм, как Т. intermedius, не растет на средах с глюкозой или глутаматом без дрожжевого автолизата, но добавление этих соединений или дрожжевого автолизата к минеральной среде с тиосульфатом заметно ускоряет рост культур и увеличивает биомассу. При этом бактерии большую часть углерода клеток строят из органических субстратов. Фиксация углекислоты резко снижается из-за подавления синтеза рибулезодифосфаткарбоксилазы — ключевого фермента цикла Кальвина. Снижается также скорость окисления тиосульфата.
Есть и такие представители тиобацилл, которые легко переключаются с автотрофного на гетеротрофный образ жизни и рост их на органических средах не зависит от наличия восстановленных соединений серы. К ним принадлежат Т. novellus и другие близкие организмы, которые способны хорошо расти на средах с разными сахарами, спиртами, органическими кислотами и аминокислотами. При этом некоторые органические соединения (глюкоза, лак-тат, глицерин, пируват) полностью подавляют способность Т. novellus окислять тиосульфат, тогда ка-к другие (сукцинат, цитрат, аланин, глутамат) почти не оказывают действия. Показано также, что в результате роста на среде с глутаматом активность рибулезодифосфаткарбоксилазы у Т. novellus составляет менее 1% от активности в клетках, выросших на минеральной среде.
Таким образом, возможность автотрофной фиксации углекислоты почти утрачивается, хотя способность бактерий окислять тиосульфат сохраняется.
Описаны, наконец, тионовые бактерии, которые вообще растут только на органических средах. Однако их рост в таких условиях ускоряется в присутствии тиосульфата, который они окисляют до сульфата, видимо, с получением энергии, т. е. ведут себя как хемолито-гетеротрофы. К таким организмам принадлежит Т. permetabolis. К числу тионовых бактерий иногда относят и Т. trautweinii, который также проявляет способность окислять тиосульфат, но растет только на органических средах. Однако полагают, что для данных бактерий, как и для некоторых других гетеротро-фов, окисление тиосульфата не имеет существенного биологического значения, а является побочной реакцией.
Таким образом, среди тионовых бактерий есть организмы с разными потенциями к автотрофному и гетеротрофному образу жизни. Причина, почему Т. permetabolis не растет в автотрофных условиях, видимо, состоит в том, что эти бактерии не образуют рибулезодифосфаткарбоксилазу и не могут фиксировать углекислоту через цикл Кальвина. У Т. intermedius, которая хотя и растет на минеральной среде, но медленно, активность этого фермента по сравнению с другими тионовыми бактериями, растущими в автотрофных условиях, слабая. Следовательно, ограниченные способности Т. intermedius к росту в автотрофных условиях и отсутствие таковой у Т. permetabolis связаны с возможностями этих бактерий использовать углекислоту для образования разных компонентов клеток.
С другой стороны, исследователей давно интересует вопрос, почему некоторые тионовые бактерии и другие автотрофные микроорганизмы (нитрификаторы, фототрофы) проявляют ограниченные возможности использовать в своем метаболизме экзогенные органические соединения и нуждаются, как правило, в специфическом источнике энергии. Причины этого выяснены не до конца. Существуют разные предположения.
Некоторые исследователи считают, что исходные органические субстраты или продукты их метаболизма могут оказывать токсическое действие на определенные виды автотрофов. Но если удалять такие метаболиты, то можно получить рост культур и в гетеротрофных условиях.
Однако экспериментальные данные, подтверждающие эту гипотезу, пока ограничены и нуждаются в дальнейшей проверке.
Второе предположение заключается в том, что для проникновения органических веществ в клетки автотрофов требуется затрата энергии, источником которой служит либо свет (для фотоавтотрофов), либо неорганические окисляемые субстраты (для хемоавтотрофов). Кроме того, облигатная зависимость некоторых автотрофов от восстановленных соединений серы или азота может быть связана с тем, что они используются в конструктивных процессах. Например, известно, что Т. neapolitanus ассимилирует серу только в восстановленной форме, так как не обладает способностью к ассимиляционной сульфатредукции, а Т. denitrificans нуждается в аммонии не только как в источнике энергии, но и как в источнике азота.
Есть также ряд данных, позволяющих предполагать, что ограниченные возможности некоторых автотрофов использовать органические соединения обусловлены определенными нарушениями ферментных систем, участвующих в их метаболизме. Известно, что многие автотрофные микроорганизмы, которые плохо или совсем не растут на органических средах, не проявляют активности а-кетоглутаратдегидрогеназы. Поэтому полный цикл трикарбоновых кислот, через который происходит окисление ацетата и других органических кислот, у них действовать не может. У некоторых автотрофов (например, у Т. neapolitanus) не обнаружена также изиоцитрат-лиаза — один из специфических ферментов глиоксилатного цикла. Все это ограничивает использование органических соединений и в конструктивных процессах.
Использование органических соединений может тормозиться низкой активностью ряда ферментов. Например, известно, что у Т. denitrificans очень слабая активность малатдегидрогеназы и сукцинатдегидрогеназы. Возможны дефекты и в других ферментных системах. Наиболее вероятным считают, что ограниченные способности некоторых автотрофов использовать органические соединения обусловлены рядом их особенностей, а не каким-нибудь одним свойством. Однако вопрос этот требует дальнейшего детального изучения. На основании имеющихся сейчас данных можно сказать, что все исследованные автотрофы в той или иной степени проявляют способность использовать экзогенные органические соединения, причем в первую очередь как дополнительные источники углерода. Поэтому термин «облигатные автотрофы» по существу не правилен. В действительности к облигатным автотрофам относят организмы, нуждающиеся в свете или неорганических субстратах как источниках энергии и в углекислоте как основном источнике углерода, но способные в ограниченной степени ассимилировать органические соединения. В отличие от этого, так называемые факультативные автотрофы легко переключаются на использование органических соединений в качестве источников энергии и основных источников углерода.
Кроме рассмотренных выше тионовых бактерий, известно несколько других хемоавтотрофов, окисляющих соединения серы.
Так из морского ила недавно выделены подвижные спириллы, клетки которых обычно небольшие (0,2—0,3 х 1,0—4,0 мкм), но могут достигать 20—30 мкм в длину. Этот микроорганизм, названный Thiomicrospira pelophila, по своей физиологии очень похож на Thiobacillus thioparus. Рост происходит в аэробных условиях на минеральных средах, содержащих сульфид, серу, тиосульфат или тетратионат. Оптимальное значение рН 6,5—7,5; температуры 28-30 °С.
Еще раньше М. А. Егоровой и З.П. Дерюгиной были описаны спорообразующие бактерии Thiobacillus thermophila из термального источника, которые росли на минеральной среде с сульфидом или тиосульфатом при 55—60 °С.
Выделено также два других автотрофных термофильных микроорганизма. Оба они отнесены к новому роду — Sulfolobus — дольчатых серных бактерий. Один из них, названный Sulfolobus acidocaldaris, растет как в автотрофных условиях, окисляя серу, так и на органических средах при значениях рН от 0,9 до 5,8 (оптимум 2,0—3,0). Рост возможен при 55—85 °С. Оптимальная температура 70—75 °С. Встречается в горячих источниках и окружающей почве. Второй представитель этого рода также выделен из горячего источника с кислой реакцией воды. Оптимальное рН для его роста около 2,0. Максимальная температура, при которой возможен рост, 75 °С, минимальная 45 °С. Рост наблюдается на минеральной среде, содержащей молекулярную серу или двухвалентное железо.
Микроорганизмы, окисляющие неорганические соединения серы, играют весьма существенную роль в процессах их превращения в природе (рис. 5). Особенно важное значение в круговороте серы, видимо, имеют тионовые бактерии, широко распространенные в различных водоемах, почве и в разрушающихся горных породах.
В результате деятельности этих микроорганизмов, а также бесцветных и окрашенных серобактерий происходит окисление значительной части сероводорода и других соединений серы в водоемах. Причем в некоторых случаях имеет место отложение значительного количества серы. Активное окисление серы тионовыми бактериями в почве нашло практическое применение. Для уменьшения щелочности почвы вносят элементарную серу, которая быстро окисляется этими микроорганизмами с образованием серной кислоты.
Так называемое сернокислое выветривание горных пород также обусловлено деятельностью тионовых бактерий и является результатом образования ими серной кислоты. Такова же нередко причина порчи некоторых каменных и металлических сооружений.
Есть основания считать, что наряду с десуль-фатирующими бактериями, которые восстанавливают сульфаты до сероводорода, тионовые бактерии участвовали в какой-то степени в образовании некоторых месторождений самородной серы, окисляя сульфиды до молекулярной серы. Но эти же микроорганизмы могут являться основной причиной быстрого разрушения серных руд, проводя окисление до конца, т. е. до серной кислоты. Такие процессы, как показано С. И. Кузнецовым и его сотрудниками, нередко имеют место при разработке серных месторождений, когда создаются аэробные условия.
Таким образом, деятельность микроорганизмов, окисляющих серу и различные ее соединения, по своим результатам достаточно разнообразна.
Дата добавления: 2015-06-12; просмотров: 1009;
