Железобактерии
Известно значительное число микроорганизмов, прямо или косвенно участвующих в окислении железа. Некоторые из них были открыты еще в середине прошлого века, но до сих пор в виде чистых культур удалось получить лишь немногие. Поэтому сведения о биологии большинства таких форм весьма ограничены и основаны на изучении либо только природного материала, либо накопительных культур.
На основании имеющихся данных можно, однако, заключить, что многие из них являются гетеротрофами. К числу таковых принадлежат микроорганизмы, окисляющие комплексные органические соединения железа. В результате этого железо в виде гидрата окиси откладывается на поверхности клеток. Такие микроорганизмы встречаются и в водоемах, и в почве. К числу водных форм относятся Siderocapsa, Blastocaulis, Neumanniella, Ochrobium и некоторые другие. В почве в разложении гума-тов железа, видимо, участвуют почкующиеся бактерии родов Hyphomicrobium, Pasteuria и Seliberia stellata. Описаны также разнообразные по морфологии микроорганизмы, которые, судя по ряду данных, могут окислять неорганические соединения железа в болотах, ручьях, железистых источниках, дренажных трубах, в озерах и других водоемах с образованием охристых осадков. Некоторые встречаются и в почве. Именно такие формы были названы железобактериями. К ним принадлежат представители нитчатых бактерий (Leptothrix, Toxo-thrix, Crenothrix), а также Gallionella, Sidero-coccus, Methallogenium. Наиболее широко распространены нитчатые бактерии, называемые Leptothrix ochracea. По описаниям палочковидные клетки этой бактерии собраны в цепочки и окружены влагалищем, где откладывается гидрат окиси железа. Благодаря наличию жгутиков клетки способны к движению и могут покидать влагалище. Обычно встречается в ручьях, у выхода железистых источников на болотах, образуя скопления в виде ржавых пятен.
Хотя еще С. Н. Виноградский (1888) показал, что L. ochracea превращает закисное железо в окисное, способность этих бактерий к авто-трофному образу жизни не доказана и все данные о биологии основаны, по существу, на исследовании природного материала. Окончательно не решено даже, является Leptothrix самостоятельным родом или это представители Sphaerotilus, гетеротрофной нитчатой бактерии, которая способна откладывать вокруг клеток окислы железа. Кроме L. ochracea, описан ряд других видов Leptothrix, но сведения о них также весьма ограничены.
Второй организм, который давно привлекает к себе внимание в связи с особенностями морфологии и физиологических свойств, — это Gallionella. Выделяют несколько видов, наиболее известен Gallionella ferruginea. Согласно описаниям Н. Г. Холодного, Gallionella состоит из бобовидных отдельных клеток, которые выделяют с вогнутой стороны гидрат окиси железа, образующего переплетенные нити. Более поздние работы с использованием электронной микроскопии подтвердили, что в культурах Gallionella встречаются вибриоидные клетки со жгутиками. От таких клеток могут отходить стебельки в виде нитей, состоящих из отдельных волокон. Обнаружено также наличие на нитях расширений (мембранных мешков) и мелких округлых телец, похожих на почки. Химические реакции доказывают наличие в нитях белка. Все это говорит о том, что данные образования не являются чисто гидратом окиси железа, а, видимо, имеют «живые элементы». Работы последних лет позволяют предполагать, что под названием Gallionella описаны комплексные культуры, один из компонентов которых, видимо, относится к микоплазмам. Очевидно, вопрос о природе Gallionella будет совсем решен после выделения несомненно чистых культур. Пока таковых не имеется, хотя накопительные культуры получить довольно просто. Для этого используют минеральную среду, содержащую сульфид железа или металлическое железо, и обеспечивают снабжение углекислотой. Тот факт, что Gallionella растет на такой среде и фиксирует 14С02, говорит о возможности ее существования в автотрофных условиях.
Для окончательных выводов необходимы дальнейшие исследования.
Сведения о других микроорганизмах, перечисленных выше, еще более ограничены. Есть основания полагать, что в число железобактерий попало немало микроорганизмов, для которых процесс окисления железа не имеет какого-либо физиологического значения, но они могут концентрировать железо в слизи, окружающей клетки, когда в результате изменения условий оно окисляется химическим путем и переходит в нерастворимую форму. Такая способность обнаружена у многих нитчатых бактерий и сине-зеленых водорослей. Описаны также случаи отложения окислов железа на водной растительности.
Однако известны действительно хемоавтотрофиые микроорганизмы, которые получают энергию в результате окисления записного железа. Таковым является Thiobacillus ferrooxidans. Как уже указывалось выше, по своей морфологии и физиологическим свойствам этот микроорганизм, несомненно, принадлежит к к тионовым бактериям. Th. ferrooxidans в отличие от других представителей тиобацилл способен окислять соединения не только серы,
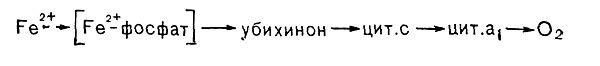
Рис. 141. Цепь переноса электрона при окислении железа у Thiobacillus ferrooxidans.
но и двухвалентного железа. Клетки этой грамотрицательной бактерии имеют вид коротких палочек (0,3—0,4 X 0,7 — 1,7 мкм) с одним полярным жгутиком. Размножаются поперечным делением. Оптимальное значение рН для роста<4,0 (1,8—3,5), температуры 28—30 °С. Растет на простых синтетических средах с аммонием или нитратами в аэробных условиях. Окисляет молекулярную серу и различные ее соединения (S2, S2O32-, S2042-, S4062-, S032-), в том числе сульфиды тяжелых металлов. Поэтому широко распространен в месторождениях различных сульфидных минералов. Окисление Т. ferrooxidans двухвалентного железа происходит согласно уравнению
4Fe2++4H++6S042-+02 -> 2Fe2(S04)3+ 2Н20, дельта F = —46,2*103 дж.
Поскольку реакция сопровождается малым выходом энергии (46,2 -103 дж/г окисленного железа), то для поддержания роста бактериям приходится окислять весьма большие количества железа. Так, при образовании 1 г сырой биомассы происходит окисление 500 г сернокислого железа. Образование Т. ferrooxidans АТФ сопряжено с функционированием электрон-транспортной дыхательной цепи, которая, как и у ряда других хемоавтотрофов, укорочена. Это связано с тем, что Fe2+ имеет весьма высокий положительный потенциал (Е-0= 0,77 В). Полагают, что сначала железо образует с фосфатом комплексное соединение, имеющее более низкий окислительно-восстановительный потенциал (Е2-0 = О В), и лишь затем передает электрон в дыхательную цепь (рис. 141) на уровне либо убихинона, либо цитохрома. Поэтому образование восстановленного НАД Т. ferrooxidans происходит в результате действия системы обратного переноса электрона с затратой энергии.
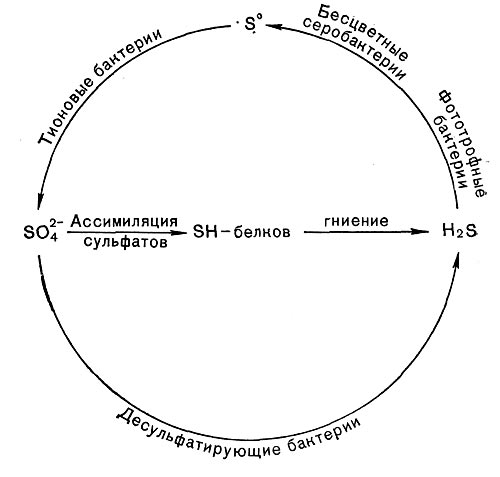
Рис. 142. Схема круговорота серы.
Т. ferrooxidans обычно выращивают на минеральных средах, содержащих углекислоту и восстановленные соединения серы или соли двухвалентного железа. Лишь недавно появились сообщения о способности некоторых штаммов этих бактерий расти на среде с глюкозой в отсутствие неорганических окисляемых субстратов. Однако способность Т. ferrooxidans к переключению на такой гетеротрофный метаболизм требует дальнейшего изучения и проверки.
До последнего времени не было известно других бактерий, способных, подобно Т. ferrooxidans, расти в автотрофных условиях, окисляя двухвалентное железо. Однако сейчас такая возможность показана еще у двух микроорганизмов. Один из них, как уже указывалось выше, принадлежит к дольчатым бактериям Sulfolobus и способен, кроме железа, окислять молекулярную серу. Второй микроорганизм представляет собой небольших спирилл и растет на минеральной среде, окисляя железо. Он назван Leptospirillum ferrooxidans. Есть также сообщения, что такой способностью обладают некоторые представители рода Metallogenium.
Имеющиеся данные позволяют заключить, что автотрофные и некоторые гетеротрофные микроорганизмы принимают участие в превращениях железа в природе, в частности в образовании железистых отложений, из которых формируются осадочные железные руды в болотах, озерах и других водоемах.
Весьма существенное значение имеет также деятельность Т. ferrooxidans в месторождениях сульфидных руд. Способность Т. ferrooxidans окислять практически все известные сульфидные минералы находит практическое применение в гидрометаллургии.
Тионовые бактерии принимают также активное участие в круговороте серы (рис. 142).
В заключение следует отметить, что некоторые микроорганизмы способны окислять и концентрировать вокруг себя не только железо, но и марганец (Mn+2 -> Мn+4). Таким свойством обладает ряд нитчатых бактерий, а именно: некоторые представители Leptothrix (например, L. discophora), Crenothrix polyspora, Lieskeela discophora, а также Naumannilla, Kuznezovia polymorpha, Blastocaulis, Siderocapsa и Hyphomicrobium. Известны формы, окисляющие только марганец. К числу таковых принадлежат некоторые почкующиеся бактерии из родов Hyphomicrobium и Metallogenium. Один из них, Metallogenium symbioticum, выделенный Г. А. Заварзиным, растет в симбиозе с грибом и, как установлено Г. А. Дубининой, относится к микоплазмам. К этому организму, видимо, близок Caulococcus manganifer, также окисляющий марганец. Кроме того, показано, что окислять марганец могут разные почвенные грибы и ряд бактерий таких родов, как Bacillus, Pseudomonas, Achromobacter, Flavobacterium, Corynebacterium, Sarcina, Escherichia и др.
Часто, однако, окисление марганца происходит только в смешанных или симбиотиче-ских культурах.
По всем данным микробиологические процессы имеют большое значение в превращениях марганца и в почве и в разных водоемах, где нередко происходит отложение марганца и образование железомарганцевых конкреций. Однако ни для одного марганецокисляющих микроорганизмов не показана способность к росту в автотрофных условиях. И хотя предположения о возможности получения ими энергии при окислении марганца
4MnC03+02 -> 2Mn203+2C02, дельта F = — 31,9 * 104 Дж
высказывались, они остаются не доказанными.
Таблица 44. Палочковидные бактерии (по) и бактероиды из клубеньков чины, вики, акации (увел, х 6000—10 000).

Таблица 45. Бактериоз пшеницы: 1,2 — базальный; 3 — желтый слизистый.
Дата добавления: 2015-06-12; просмотров: 2503;
