Химизм и механизм реакций каталитического крекинга.
Катализ кислотами широко применяется в НПП. Каталитическое действие кислот обусловлено образованием при их взаимодействии с углеводородами катионов, называемых карбоний-ионами. Карбоний-ион - это промежуточная структура, в которой водорода на один атом меньше, чем в исходной молекуле парафинов и нафтенов, и на один атом водорода больше, чем в исходной молекуле олефинов и замещенных ароматических углеводородов.
При термическом крекинге через свободные радикалы промежуточные продукты также содержат на один атом водорода меньше, чем исходные молекулы. Отсюда в обоих случаях промежуточная структура углеводорода всегда содержит нечетное число атомов водорода. При каталитическом крекинге такая структура существует в ионной форме, а при термическом крекинге она появляется в форме свободного радикала.
Для каталитического крекинга типичным является ионное, гетеролитическое расщепление связи С-С, которое выражается следующей электронной структурой: 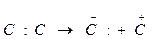 (260 кДж/моль).
(260 кДж/моль).
В противоположность этому для термического крекинга характерно свободнорадикальное расщепление связи С-С: С:С → С· + С· (74 кДж/моль).
С энергетической точки зрения между этими вариантами имеется существенное различие, поскольку в то время, как для разделения, например, н-гексана на два пропильных радикала требуется только 76 кДж/моль, а для разделения н-гексана на два н-пропильных иона, положительный и отрицательный, необходимо около 260 кДж. Тем не менее для образования такой пары ионов не требуется большого количества энергии, так как ионный механизм в качестве предварительной стадии предусматривает образование положительного иона с переносом протона, и эта стадия инициируется ионным каталитическим реагентом. Предполагается, что заряженные осколки находятся в тесной близости со своими партнерами и с катализатором.
По-видимому, в начальной стадии инициирования образования карбоний ионов происходит термическое расщепление углеводородов с образованием олефинов, которое над кислотным катализатором быстро образуют ионы карбония R+.
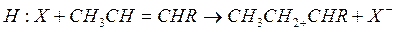
Кислоты Льюиса являются энергичными акценторами электронной пары и также могут инициировать реакцию с участием карбоний иона:
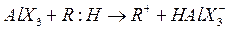
Образование карбоний ионов облегчается, если в системе имеется небольшое количество галогеналкинов: 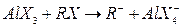
Галогеналкилы здесь играют роль промоторов.
Карбоний ионы очень реакционно-активные соединения. Константы скорости ионных реакций на несколько порядков выше аналогичных радикальных реакций. Об относительной устойчивости карбоний ионов можно судить по теплоте их образования (кДж/моль):
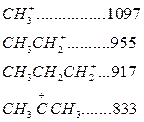 ↓ устойчивость возрастает
↓ устойчивость возрастает
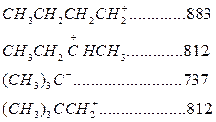 ↓ устойчивость возрастает
↓ устойчивость возрастает
Как следует из этих данных, стабильность карбоний ионов возрастает в последовательности: первичный < вторичный < третичный.
Основными реакциями карбоний ионов, как и радикалов, являются мономолекулярный β-распад и бимолекулярные реакции замещения и присоединения. Существенной реакцией также является изомеризация карбоний иона.
Кратко рассмотрим механизм превращения углеводородов в каталитическом крекинге.
1. Инициирование цепи
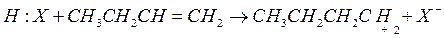
2. Изомеризация карбоний иона
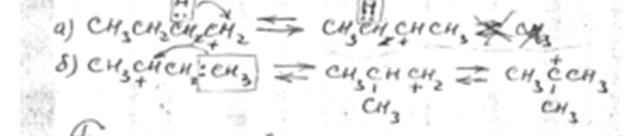
по схеме «а» изомеризация осуществляется за счет переноса гидрид иона, а по схеме «б» - за счет переноса метил иона.
Перемещение заряда происходит в направлении от первичного иона карбония к вторичному и далее к наиболее устойчивому – третичному. Реакция экзотермична.
3. β-распад. Расщепление карбоний иона обычно происходит по наиболее слабой связи β С-С.
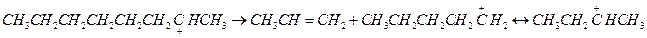
Склонность к β-распаду снижается в порядке первичный > вторичный > третичный карбоний ион. Так, для распада первичного октил иона требуется 92 кДж/моль.
Склонность к распаду увеличивается при отщеплении вторичного иона и еще больше увеличивается при отщеплении третичного иона
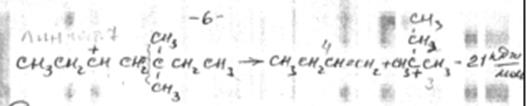
Сопоставление энергетики распада и изомеризации карбоний ионов показывает, что изомеризация должна предшествовать в большинстве случаев распаду. Преимущественное образование третичных карбоний ионов и их устойчивость должны приводить к накоплению углеводородов изостроения при распаде карбоний ионов нормального строения. Реакции распада эндотермичны.
4. Присоединение карбоний иона к олефинам и ароматическим углеводородам.
Эти реакции можно рассматривать, как обратные реакции распада. Поэтому характер изменения теплового эффекта противоположен реакции распада, то есть эти реакции экзотермичны.
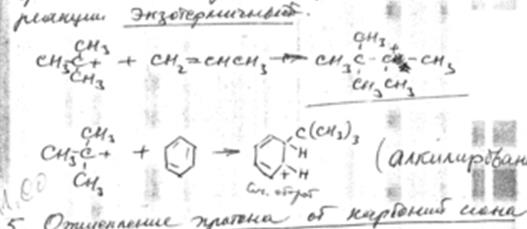
5. Отщепление протона от карбоний иона и передача протона молекуле олефина.

Эта реакция направлена на образование из первичных карбоний ионов вторичных, а затем третичных.
6. Отрыв гидрид иона от молекулы углеводорода. Активность карбоний иона в реакции отрыва гидрид иона также снижается в ряду:
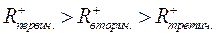
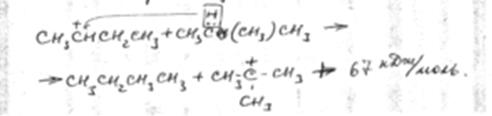
Несколько слов о сырье каталитического крекинга и катализаторах.
Дата добавления: 2015-06-12; просмотров: 6527;
