Физико-химические основы разделения нефтяного сырья избирательными растворителями
Среди физических процессов переработки нефти широкое распространение получили процессы разделения нефтяного сырья избирательными растворителями. Сюда относятся процессы деасфальтизации, селективной очистки масел, депарафинизации, жидкостной экстракции ароматических углеводородов.
Растворение одного вещества в другом возможно лишь в том случае, когда силы притяжения между одноименными молекулами преодолеваются силами притяжения между разноименными молекулами. Пример: силы притяжения между молекулами ароматических углеводородов и силы притяжения между молекулами фенола преодолеваются силами притяжения между молекулами ароматических углеводородов и фенола.
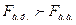 ;
; 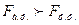
Межмолекулярное взаимодействие обусловлено силами Ван-дер-Ваальса. Различают две группы межмолекулярных сил:
1. силы неспецифического взаимодействия, сюда относятся ориентационные, индукционные и дисперсионные;
2. направленные, специфические силы, сюда относятся водородные связи.
Вспомним физическую сущность этих межмолекулярных связей.
Ориентационные силы. Эти силы обусловлены электростатическим взаимодействием молекул, обладающих постоянным дипольным моментом (полярные молекулы). Примерами таких соединений могут служить соединения, содержащие в молекуле гетероатомы (кислород, азот, сера и т.д.). вокруг полярных молекул образуется электрическое поле, в котором молекулы ориентируются относительно друг друга, что приводит к их притяжению и образованию гомогенного раствора. Ориентационные силы притяжения тем больше, чем больше дипольные моменты взаимодействующих молекул. Тепловое движение нарушает взаимную ориентацию молекул, поэтому ориентационное взаимодействие является функцией температуры.
Индукционные силы. Индукционные силы возникают при неравномерном распределении электронной плотности в молекуле за счет влияния силового поля полярных молекул. В результате происходит образование наведенного (индуцированного) диполя в нейтральной молекуле. Величина наведенного (индуцированного) диполя определяется силой электрического поля  полярной молекулы и способностью неполярной молекулы к поляризации
полярной молекулы и способностью неполярной молекулы к поляризации  .
.
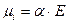
Под поляризуемостью понимается способность неполярных молекул перераспределять по молекуле электроны под действием внешнего силового поля. Поляризуемость практически не зависит от температуры. Примером молекул, способных к образованию индуцированного диполя, являются молекулы ароматических углеводородов. Это объясняется большей подвижностью в молекуле ароматических углеводородов  -электронов, которые сравнительно легко перераспределяются в молекуле под действием внешнего силового поля.
-электронов, которые сравнительно легко перераспределяются в молекуле под действием внешнего силового поля.
Дисперсионные силы. В молекулах с равномерным распределением электронов за счет различных внешних сил молекулы могут приобретать мгновенный дипольный момент. Этот дипольный момент может поляризовать другую молекулу и тогда между ними произойдет электростатическое взаимодействие. Дисперсионное взаимодействие не зависит от температуры и проявляется при любой температуре. Оно проявляется не только при взаимодействии неполярных молекул, но и при взаимодействии полярных молекул. На дисперсионное взаимодействие приходится основная часть сил притяжения многих полярных молекул с большой поляризуемостью. На растворение любых компонентов нефтяного сырья в растворителе любой природы преобладающее влияние оказывают дисперсионные силы.
Водородная связь. Водородная связь возникает между молекулами соединений, в которых атом водорода связан с электроотрицательным атомом 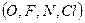 . В таких системах молекулы сильно ассоциированы за счет взаимодействия положительно заряженного атома водорода с отрицательно заряженным (электроотрицательным) атомом другой молекулы. Например, в спиртах:
. В таких системах молекулы сильно ассоциированы за счет взаимодействия положительно заряженного атома водорода с отрицательно заряженным (электроотрицательным) атомом другой молекулы. Например, в спиртах:
|
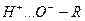
|
 и т.д.
и т.д.
Такой тип ассоциации называется водородной связью. Водородная связь может возникать как между молекулами, так и внутри молекулы. Природа их такая же, что и валентных связей, но по величине много слабее их. Но они значительно сильнее, чем Ван-дер-Ваальсовые силы. Энергия водородных связей обычно составляет 8-30 кДж/моль и более.
Водородная связь чаще всего возникает за счет диполь-дипольного взаимодействия между группой с поляризованной связью 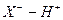 и с частицей с неподеленной парой электронов
и с частицей с неподеленной парой электронов 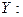 . Образование водородной связи происходит легче при пониженных температурах, с повышением температуры водородные связи рвутся вследствие усиления теплового движения молекул.
. Образование водородной связи происходит легче при пониженных температурах, с повышением температуры водородные связи рвутся вследствие усиления теплового движения молекул.
В процессах переработки нефтяного сырья с применением растворителей могут проявиться все виды межмолекулярного взаимодействия. С повышением температуры роль ориентационного взаимодействия и водородных связей снижается, роль дисперсионных сил возрастает.
По способности растворять углеводороды органические растворители можно разделить на две группы:
1. растворители, неограниченно растворяющие нефтяные углеводороды при обычной температуре. Такими растворителями являются жидкие и сжиженные алканы, а также неполярные органические растворители с небольшим дипольным моментом - 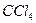 (четыреххлористый углерод),
(четыреххлористый углерод), 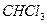 (хлороформ),
(хлороформ),  (этиловый эфир) и т.д.
(этиловый эфир) и т.д.
2. полярные органические соединения с высоким дипольным моментом. Растворимость компонентов нефтяного сырья в этих растворителях зависит от их соотношения и температуры. Растворители, проявляющие разную растворяющую способность по отношению к различным компонентам нефтяного сырья, называют селективными растворителями. К ним можно отнести также соединения как фенол, фурфурол, крезолы, алифатические кетоны (МЭК), диэтиленгликоль и т.д.
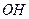
/ \
| 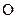 | фенол
| фенол
\ /
__
| 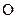 | фурфурол
| фурфурол
\ / 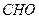
 кетоны
кетоны
||
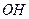
/ \
|  |
|
\ /
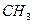
При смешении нефтяного сырья с растворителями второй группы при обычной температуре происходит частичное растворение сырья в растворителе и растворителя в сырье, в результате образуется две сосуществующие фазы. При дальнейшем увеличении кратности растворителя растворимость в нем компонентов сырья повышается, и в определенном соотношении растворителя к сырью происходит полное смешение (рисунок).
Если при неизменном соотношении растворитель: сырье повышать температуру, то также будет происходить увеличение растворимости компонентов в растворителе и при определенной температуре произойдет полное смешение растворителя и сырья. Эта температура называется критической температурой растворения (КТР). Выше этой температуры сырье полностью смешивается с растворителем, т.е. система становится однофазной. КТР является важной характеристикой селективного растворителя, определяющей его технологичность. Если селективный растворитель имеет высокую КТР, то при использовании таких растворителей нужно поддерживать высокую температуру. Это может оказаться экономически нецелесообразным. Слишком низкая КТР также может оказаться экономически невыгодной, т.к. для создания низких температур необходимо затратить много энергии.
В процессах разделения с использованием неполярных растворителей растворение компонентов сырья в растворителе происходит за счет дисперсионных сил взаимодействия между молекулами. Примером такого процесса служит процесс деасфальтизации гудрона. В качестве растворителя используется сжиженный пропан, в котором лучше растворяются неполярные компоненты, т.е. углеводороды, а полярные, гетероатомные соединения высаживаются.
В процессах разделения с использованием полярных растворителей растворение компонентов сырья происходит за счет взаимодействия постоянных диполей молекул растворителя с индуцированными диполями молекул углеводородов, а также за счет взаимодействия постоянных диполей молекул растворителя и полярных гетероатомных соединений сырья. Примером таких процессов являются процессы селективной очистки масел и экстракция ароматических углеводородов.
Чем больше дипольные моменты взаимодействующих молекул, тем ниже их КТР.
На 12.10.06
Среди нефтяных углеводородов наибольшей поляризуемостью обладают арены и поэтому они имеют низкий КТР. За ним и следуют нафтено-ароматические и нафтеновые углеводороды. В этой же последовательности повышается критическая температура их растворения. Наиболее высокую КТР имеют алканы нормального строения, что связано с их низкой поляризацией.
Строение молекул существенно влияет на КТР. Увеличение числа колец в молекуле ароматического углеводорода приводит к снижению КТР, а удлинение боковой цепи ароматического кольца приводит к повышению КТР. С увеличением числа колец в молекуле критическая температура растворения пятичленных нафтенов снижается более интенсивно, чем шестичленных.
В полярном растворителе в первую очередь растворяются полициклические ароматические углеводороды с короткими алкильными цепями, т.к. именно в этих углеводородах индуцируется дипольный момент. Нафтеновые и парафиновые углеводороды в полярных растворителях растворяются преимущественно под действием дисперсионных сил.
Как было сказано выше, растворимость компонентов сырья в растворителе зависит от природы растворителя, которая оценивается растворяющей способностью и селективностью.
Под растворяющей способностью понимают способность растворителя наиболее полно растворять компоненты сырья, подлежащие извлечению.
Избирательность (селективность) растворителя характеризует его способность четко отделять одни компоненты сырья от других.
Между растворяющей способностью и селективностью с одной стороны и строением молекул этих растворителей – с другой, существует сложная связь. На эти показатели растворителей влияют полярность функциональных групп в молекуле, их число, взаимное расположение в молекуле, величина и строение углеводородного радикала молекулы растворителя и т.д. Все эти показатели в конечном итоге влияют на силовое поле молекулы и на энергию взаимодействия молекул растворителя между собой и с молекулами компонентов сырья.
Функциональные группы по влиянию на избирательность растворителей располагаются в следующем порядке:

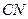
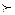 CHO
CHO 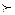
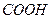
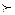 OH
OH 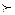

нитро нитрил альдегид карбоксил гидроксил амин
с увеличением числа функциональных групп в молекуле растворяющая способность растворителя обычно снижается.
В практике использования селективных растворителей стремятся добиться определенного соотношения между растворяющей способностью и селективностью. Для этого используют или смешанные растворители или к основному растворителю добавляют небольшое количество другого растворителя, улучшающего одно из свойств основного.
Для снижения растворяющей способности основного растворителя чаще всего добавляют воду. Но при этом изменяется и селективность растворителя.
Для повышения растворяющей способности растворителя на практике широко используют органические неполярные растворители – бензол, толуол. Например, в процессе депарафинизации масел к основному растворителю (метилэтилкетону) добавляют толуол. Подбирая соотношение МЭК: толуол и температуру можно добиться таких условий, когда в растворителе не растворяются твердые (парафиновые) углеводороды и растворяются все остальные. Такой процесс удаления твердых углеводородов из масляных фракций широко используется в промышленности.
Такой же способ регулирования растворяющей способности растворителя можно использовать и в процессе деасфальтизации гудрона пропаном. Так, при добавлении к пропану метана, этана, некоторых спиртов его растворяющая способность уменьшается. Бутан, пентан, другие высшие гомологи метана, олефины, некоторые полярные растворители повышают растворяющую способность пропана.
При рассмотрении теоретических основ разделения растворителями необходимо знание основ теории жидкость-жидкостного фазового равновесия.
При рассмотрении фазовых равновесий в процессах разделения нефтяного сырья разделяемая нефтяная фракция условно принимается состоящей из двух компонентов: растворимый и нерастворимый в селективном растворителе.
Такая система, содержащая подлежащее разделению нефтяное сырье и растворитель, принимается как тройная система.
При описании тройных систем принято, что смешиваемые вещества и образующиеся фазы являются жидкими и что при смешивании не происходит никаких химических реакций или образования твердых молекулярных соединений. Обычно это условия экстракционного процесса.
При смешении трех любых веществ могут образовываться системы, состоящие из одной фазы, либо из двух или трех.
Общий состав тройной системы можно изобразить точкой в равностороннем треугольнике. Если точку внутри равностороннего треугольника соединить линиями, параллельными его сторонам, с точками, лежащими на каждой из его сторон, то сумма длин соединяющих линий будет постоянна и равна стороне треугольника (рисунок).
Проведем из точки  параллельно сторонам соединяющие линии
параллельно сторонам соединяющие линии  ,
, 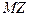 ,
, 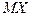 . Очевидно, что
. Очевидно, что
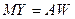 ,
,
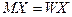 ,
,
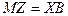 ,
,
и в результате суммирования получим
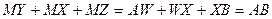
Состав тройной системы выражается отношением отрезков прямых  ,
, 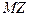 ,
, 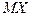 . Если длину стороны треугольника взять за 100 (или 1), то длины этих отрезков выражают содержание компонентов в процентах (или в долях).
. Если длину стороны треугольника взять за 100 (или 1), то длины этих отрезков выражают содержание компонентов в процентах (или в долях).
Так, все системы, состав которых задан на прямой 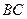 , не содержат компонента
, не содержат компонента  . Все системы, состав которых представлен точкой на линии
. Все системы, состав которых представлен точкой на линии 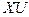 , содержат 30% компонента
, содержат 30% компонента  , т.к. точка
, т.к. точка  представляет бинарную систему компонентов
представляет бинарную систему компонентов  и
и 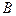 , а точка
, а точка 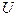 - бинарную систему компонентов
- бинарную систему компонентов  и
и 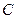 , также содержащую 30% компонента
, также содержащую 30% компонента  . Точно также все точки линии
. Точно также все точки линии  выражают составы, содержащие 50% компонента
выражают составы, содержащие 50% компонента 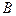 , а все точки на линии
, а все точки на линии 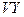 выражают составы, содержащие 20% компонента
выражают составы, содержащие 20% компонента 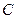 .
.
Линии 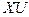 ,
,  и
и 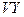 пересекаются в точке
пересекаются в точке  ; это означает, что точка
; это означает, что точка  представляет тройную систему состава: 50% -
представляет тройную систему состава: 50% - 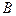 , 20% -
, 20% - 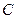 и 30% -
и 30% -  .
.
Каждая сторона треугольника представляет бинарную систему, а каждая точка внутри него – тройную систему.
Кривая, ограничивающая гетерогенную (двухфазную) область от гомогенной называется бинодальной кривой. Экспериментально она определяется титрованием смеси 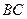 компонентом
компонентом  до исчезновения второй фазы. Беря двухкомпонентную смесь
до исчезновения второй фазы. Беря двухкомпонентную смесь 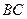 различного состава и титруя компонентом
различного состава и титруя компонентом  определяется ряд точек бинодальной кривой, в которых система становится гомогенной (рисунок).
определяется ряд точек бинодальной кривой, в которых система становится гомогенной (рисунок).
Определение экспериментальных точек (иначе называемых точками насыщения) поводится при постоянной температуре и бинодальную кривую еще называют изотермой растворимости.
Область в тройной диаграмме, ограниченная бинодальной кривой, представляет гетерогенную систему. В гетерогенной области любая система будет разделяться на две сосуществующие фазы, составы которых изображают точками, лежащими на бинодальной кривой. Линия, которая соединяет точки, представляющие составы двух равновесных, сосуществующих фаз, называется линией сопряжения или связи (рисунок). Для различных селективных растворителей и различного состава разделяемого сырья наклон линий сопряжения бывает различным.
Обычно на таких диаграммах принято помещать чистый растворитель 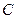 в правом нижнем углу треугольника, компонент
в правом нижнем углу треугольника, компонент 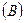 , имеющий ограниченную растворимость в растворителе, - в вершине треугольника.
, имеющий ограниченную растворимость в растворителе, - в вершине треугольника.
Дата добавления: 2015-06-12; просмотров: 3188;
