Типы транспортных белков для глюкозы у человека
| Тип глюкозо-транспортного белка | Главные места экспрессии | Чувствительность к уровню глюкозы в плазме крови | Хромосом, геном ГТБ |
| ГТБ-1 | Сосуды мозга, эритроциты, во всех тканях | Очень высокая (переносит глюкозу в капилляры мозга при ее уровне 1 ммоль/л в базальном состоянии (натощак)) | |
| ГТБ-2 | Печень, В-клетки островков поджелудочной железы | Средняя (переносит глюкозу при её уровне > 5,07 ммоль/л в постпищевом периоде) | |
| ГТБ-3 | Мозговые нейроны, во всех тканях | Очень высокая (переносит глюкозу из капилляры в клетки мозга при низком уровне глюкозы в базальном состоянии) | |
| ГТБ-4 | Мышечная, жировая ткани | Низкая (переносит глюкозу при ее уровне > 6 ммоль/л) Инсулинозависимый. | |
| ГТБ-5 | Тонкая кишка, печень, сперматозоид | Средняя (6 ммоль/л). в основном транспортирует фруктозу. | |
Метаболизм глюкозы и поддержание нормального уровня глюкозы в крови как натощак, так и после еды, тесно связан с метаболизмом белка и жира и находится под контролем гормональных, гуморальных факторов и ЦНС.
Натощак, когда пища не поступает, уровень глюкозы и инсулина в крови в пределах нормальных низких цифр. В этот период увеличена секреция контррегулирующих гормонов: глюкагона, гормона роста, катехоламинов. Эти гормоны стимулируют в адипоцитах гормонозависимую липазу, которая гидролизирует в них триглицериды (нейтральный жир) с освобождением жирных кислот и глицерола. Последние поступают в кровь, и жирные кислоты используются тканями как источник энергии. Глюкагон, катехоламины и кортизол стимулируют катаболизм белка и затем в печени из аминокислот синтез глюкозы. Кроме того, жирные кислоты снижают чувствительность жировой и мышечной ткани к инсулину. Все это направлено на поддержание нормального базального уровня глюкозы в плазме крови. Низкий уровень глюкозы и инсулина в крови, повышение уровня глицерола и адипсина в плазме стимулируют в гипоталамусе центр голода, который находится в вентралатеральных ядрах гипоталамуса. Появляется чувство голода, и человек принимает пищу. В процессе еды повышается уровень глюкозы и инсулина в крови. Инсулин тормозит липолиз в адипоцитах и активирует липопротеинлипазу (ЛПЛ), которая находится на плазменной мембране жировых клеток, стимулирует поступление жирных кислот и глюкозы в адипоциты и синтез жира – липогенез. ЛПЛ активирует гидролиз триглицеридов хиломикрон и липопротеинов очень низкой плотности.
В печени инсулин тормозит глюконеогенез, а через глюкозотранспортные белки 2 и 4 стимулирует прохождение глюкозы в клетки. Спустя 2-3 ч после еды уровень глюкозы и инсулина в крови снижается до базального и вновь увеличиваются контринсулярные гормоны и описанные выше процессы. Периодичность приема пищи ведет к преобладанию контринсулярных гормонов в базальном состоянии, катаболизму белка и жира и поддержанию на нормально низких уровнях глюкозы и инсулина в крови. Прием пищи ведет к повышению уровня глюкозы и инсулина до нормально высоких цифр (до 8 ммоль/л глюкозы), подавлению катаболизма белка и жира и стимуляции их синтеза.
Факторы, участвующие в регуляции содержания глюкозы в крови
Уровень глюкозы в крови является результирующей двух процессов – поступления глюкозы в кровь и ее выхода из крови. Некоторые органы, например печень и кишечник, могут поставлять глюкозу в кровь. Печень служит поставщиком глюкозы благодаря двум протекающим в ней процессам – распаду гликогена и глюконеогенезу (синтез глюкозы из белка). Из кишечника глюкоза поступает в кровь в результате всасывания продуктов переваривания углеводов.
Многие органы, в том числе и печень, способны черпать глюкозу из крови для своего энергетического обмена или же для синтеза гликогена (печень, скелетные мышцы, сердечная мышца, мозг) или жиров. Существование многочисленных возможных путей утилизации и синтеза глюкозы заставляет удивляться постоянству уровня глюкозы в крови. У здоровых молодых мужчин в норме уровень глюкозы в крови редко превышает 100 мг% даже после приема богатой углеводами пищи, и лишь после длительного голодания или очень интенсивной физической нагрузки этот уровень падает ниже 60 мг%. Столь жесткая регуляция возможна только в двухкомпонентной системе, один компонент которой доставляет глюкозу в кровь, а другой удаляет ее из крови.
Роль печени в гомеостазе глюкозы
Печень играет ключевую роль в гомеостазе глюкозы из-за своей способности выделять ее в кровь в количествах, варьирующих в зависимости от потребностей организма. Особенно возрастает роль печени в периоды голодания; в это время она служит главным источником глюкозы в организме. Роль печени четко продемонстрирована в экспериментах Манна и его сотрудников. Они обнаружили, что после удаления печени у собак уровень глюкозы в крови быстро и неуклонно снижается и животные в конце концов погибают. Сохранить им жизнь удавалось только путем введения раствора глюкозы.
Как сказано выше, печень поставляет глюкозу в кровь двумя путями – за счет гликогенолиза и за счет глюконеогенеза.
1. Гликогенолиз. Это быстродействующая система, использующая в качестве источника глюкозы запасы гликогена. Количество доступного гликогена, конечно, ограничено; у человека, например, всего печеночного гликоген и (около 75 г) хватает для поддержания выхода глюкозы из печени на нормальном уровне лишь в течение 12 час. Начальная стадия расщепления гликогена осуществляется ферментом фосфорилазой; фосфорилаза активируется целым рядом гормонов (адреналин, глюкагон и АКТГ), секреция которых возрастает при падении концентрации глюкозы в крови ниже некоторого критического уровня.
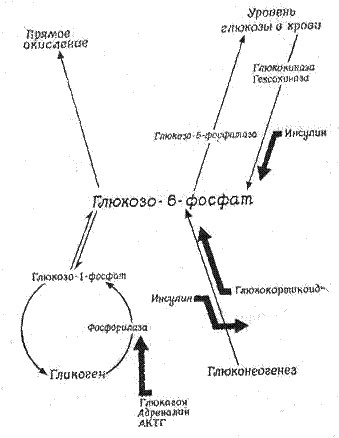
Рис. 6.3. Обмен глюкозы в печени и влияние на него гормонов.
2. Глюконеогенез. Как мы уже знаем, под глюконеогенезом понимают синтез глюкозы из неуглеводных источников. Следует уточнить, что глюконеогенез в отличие от гликогенолиза – это процесс, развивающийся сравнительно медленно; прежде чем скорость глюконеогенеза в печени возрастет в достаточной степени, для того чтобы компенсировать снижение глюкозы в крови, должно пройти несколько часов.
Обмен глюкозы в печени представлен схематически на рисунке 6.3. Центральную роль в этой совокупности превращений играет глюкозо-6-фосфат, который располагается «на перекрестке» всех путей утилизации глюкозы. Количество глюкозы, поступающей из печени в кровь, зависит от целого ряда факторов, в том числе от скорости ее поступления в печень, поглощения печеночными клетками, превращения в гликоген и от интенсивности глюконеогенеза.
Поглощение глюкозы клетками
Поглощение глюкозы клетками печени зависит от интенсивности фосфорилирования глюкозы печеночными киназами. Имеются данные, свидетельствующие о том, что инсулин способен стимулировать фосфорилирование глюкозы, усиливая тем самым поглощение глюкозы клетками печени и, следовательно, уменьшая то количество глюкозы, которое может поступать в кровь. Очевидно, процесс фосфорилирования глюкозы должен быть пространственно обособлен от фермента глюкозо-6-фосфатазы; в противном случае под действием этого фермента глюкозо-6-фосфат, образующийся при фосфорилировании глюкозы, немедленно подвергался бы дефосфорилированию с образованием свободной глюкозы и выделением тепла. Известно, что глюкозо-6-фосфатаза связана с микросомной фракцией клетки и таким образом отделена от растворимых фосфорилирующих систем.
Глюконеогенез
При глюконеогонеогезе глюкоза образуется в процессе катаболизма белка и других веществ. Механизмы, которые служат для повышения интенсивности глюконеогенеза, включаются при гипогликемии. При этом происходит активирование симпатической нервной системы, что сопровождается выбросом адреналина из мозгового вещества надпочечников. Этот гормон не только активирует печеночную фосфорилазу, стимулируя процесс выделения глюкозы из печени, но и включает более «медленные» механизмы, повышающие интенсивность синтеза глюкозы в печени. Адреналин стимулирует секрецию адренокортикотропного гормона передней долей гипофиза. Этот гормон активирует синтез и секрецию глюкокортикоидов в коре надпочечников, а глюкокортикоиды в свою очередь вызывают высвобождение из тканей лактата, различных аминокислот и трехуглеродных предшественников, т.е. сырья для синтеза глюкозы в печени. В самой печени глюкокортикоиды ускоряют синтез внутриклеточных ферментов, участвующих в глюконеогенезе. Выброс адреналина, происходящий при гипогликемии, сопровождается также высвобождением глицерина из жировой ткани, а глицерин также служит сырьем для синтеза глюкозы.
В отсутствие инсулина печень непрерывно выделяет в кровь глюкозу, даже если ее концентрация в крови высока (500 мг% у собак). В то же время в присутствии инсулина печень поглощает глюкозу из крови, даже когда ее содержание в крови падает ниже 75 мг%. По-видимому, инсулин служит важным регулирующим фактором выхода глюкозы из печени, причем регуляция осуществляется по двум механизмам (схема 1). Во-первых, он ускоряет поглощение глюкозы клетками печени и ее фосфорилирование в них, активируя специфическую глюкокиназу. Во-вторых, инсулин может уменьшать суммарный выход глюкозы из печени, снижая скорость глюконеогенеза.
Таким образом, выход глюкозы из печени изменяется в зависимости от потребностей организма. Информацию об этих потребностях несут различные гормоны, выработка которых и свою очередь находится под контролем нервной системы, и частности симпатической нервной системы; эта последняя активируется при гипогликемии.
Факторы, регулирующие утилизацию глюкозы в тканях
Печень играет очень важную роль в регуляции уровня циркулирующей в крови глюкозы, потребной для метаболических нужд центральной нервной системы. Другой важный фактор в поддержании постоянного уровня глюкозы в крови – утилизация ее различными тканями (рис. 6.4).
 |
При достаточном количестве глюкозы в рационе многие ткани способны поглощать глюкозу из крови для удовлетворения своих энергетических потребностей, а также для синтеза гликогена и жира. Если число калорий, поступающих с пищей, превышает метаболические потребности, то большое количество глюкозы может превращаться в триглицериды жировой ткани. При голодании все эти разнообразные пути утилизации глюкозы блокируются, для того чтобы ограниченные запасы глюкозы, поступающей из печени, могли использоваться центральной нервной системой. Это оказывается возможным благодаря тому, что мышцы и жировая ткань способны покрывать свои энергетические потребности за счет окисления других субстратов, например жирных кислот и кетоновых тел.
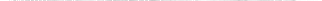 |
 |
Рис. 6.4. Эндокринная регуляция обмена глюкозы.
А. Обмен глюкозы при избыточном содержании углеводов в рационе. Инсулин, секретируемый поджелудочной железой, стимулирует синтез жиров, а также синтез гликогена в печени и мышцах и подавляет глюконеогенез в печени.
Б. При гипогликемии ситуация меняется. Образование инсулина подавляется, и поток глюкозы в мышечную и жировую ткани прекращается; из мозгового вещества надпочечников выделяется адреналин, повышающий содержание сахара в крови за счет активации печеночной фосфорилазы, высвобождения лактата из мышечной ткани и глицерина из жировой ткани (лактат и глицерин служат сырьем для глюконеогенеза в печени) и активации (через гипоталамус) секреции АКТГ передней долей гипофиза; кроме того, секретируемый поджелудочной железой глюкагон усиливает действие адреналина на фосфорилазу печени.
В. Последующие стадии реакции на гипогликемию. АКТГ, выделяющийся из передней доли гипофиза, активирует кору надпочечников, которая секретирует глюкокортикоиды; эти гормоны обеспечивают постоянство снабжения глюкозой центральной нервной системы тремя путями: во-первых, они препятствуют поглощению глюкозы мышечными и жировыми клетками; во-вторых, вызывают высвобождение аминокислот из мышц – эти аминокислоты также служат сырьем для глюконеогенеза в печени – и, в-третьих, стимулируют синтез ферментов, ответственных за глюконеогенез.
Поглощение глюкозы мышцами и жировой тканью в соответствии с количеством и качеством пищи регулируется несколькими гормонами. Мембрана многих клеток, в частности мышечных и жировых, служит барьером для свободного передвижения глюкозы из внеклеточной жидкости в клетку. Инсулин облегчает перенос глюкозы через клеточную мембрану. Максимальное образование инсулина в поджелудочной железе наблюдается при избыточном поступлении углеводов с пищей, когда количество углеводов превышает энергетические потребности центральной нервной системы. Благодаря действию инсулина избыток глюкозы направляется в мышечную и жировую ткани. Кроме того, при потреблении пищи, богатой углеводами, интенсивность образования глюкозы в печени снижается, так как инсулин подавляет глюконеогенез. При недостатке углеводов в рационе, когда уровень глюкозы в крови падает, секреция инсулина снижается; мышечные и жировые клетки не могут больше поглощать глюкозу из внеклеточной жидкости. Глюконеогенез в печени, который не подавляется больше инсулином и к тому же стимулируется глюкокортикоидами, теперь усиливается.
He во всех клетках мембрана служит препятствием для свободного поступления глюкозы. Для транспорта глюкозы в клетки центральной нервной системы и печени инсулин не требуется.
При голодании секреция инсулина низка и потому мышечные и жировые клетки должны, так или иначе, вместо глюкозы использовать другие источники энергии, тем более что имеется еще один механизм, предотвращающий утилизацию глюкозы этими тканями при голодании. Этот механизм состоит в подавлении глюкокортикоидами гексокиназной реакции в этих клетках.
Сахарный диабет
Сахарный диабет (СД) – хроническое полиэтиологичное заболевание, характеризующееся гипергликемией натощак и в течение дня и глубокими нарушениями углеводного, жирового, белкового и минерального обменов. Независимо от причин, эти нарушения, в конечном итоге, являются следствием недостатка инсулина, абсолютного или относительного. Абсолютный недостаток инсулина характеризуется резким снижением его синтеза инсулинсекретирующими В-клетками островков поджелудочной железы и его секреции в кровь. Уровень инсулина в сыворотке крови очень низкий. При относительном недостатке инсулина синтез его В-клетками длительно не нарушен и уровень инсулина в сыворотке крови нормальный или повышенный.
Сахарный диабет (СД) относится к широко распространенным заболеваниям. Им страдает около 3-4% населения. Заболеваемость СД неуклонно увеличивается.
Сахарный диабет тип 1
СД тип 1 составляет 15-20% от всех больных диабетом. Он является тяжёлым заболеванием, склонным к развитию диабетического кетоацидоза (ДКА). СД тип 1 протекает с абсолютной недостаточностью инсулина, и жизнь больных зависит от обязательного лечения инсулином. В связи с этим ранее этот диабет называли инсулинзависимым. Хотя СД тип 1 может развиться в любом возрасте, подавляющее большинство заболевает в возрасте до 30 лет. У 90% больных СД тип 1 является аутоиммунным заболеванием, тесно связанным с системой гистосовместимости тканей.
При абсолютной недостаточности инсулина резко снижается утилизация глюкозы тканями и компенсаторно увеличивается секреция контррегулирующих гормонов, главным образом глюкагона. Последние стимулируют катаболизм белка и из аминокислот в печени увеличивают образование глюкозы (глюконеогенез). Глюкоза в избытке поступает в плазму крови, и развивается гипергликемия. Одновременно контррегулирующие гормоны активируют липолиз в жировой ткани. Увеличивается поступление в плазму крови жирных кислот, из которых в печени образуются кетоновые тела, а в жировой ткани уменьшается количество жира. Инсулин, содержание которого в крови очень низкое, не может подавить глюконеогенез, липолиз и кетогенез. В результате уровень глюкозы в плазме крови продолжает нарастать, увеличивается уровень кетоновых тел и при отсутствии лечения инсулином развивается диабетический кетоацидоз (ДКА).
Заболевание у большинства больных начинается остро, когда погибает более 90% В-клеток. Появляется полиурия, нередко ночной энурез, жажда, снижение массы тела. Больной в течение 2 недель может потерять до 10 кг веса тела. Аппетит нормальный, нередко повышен. При отсутствии лечения инсулином все симптомы нарастают, появляется слабость, снижается аппетит и развивается ДКА. У некоторых больных может быть острейшее начало диабета манифестацией ДКА. Кроме вышеперечисленных «Классических» проявлений диабета, больные могут жаловаться на преходящие нарушения зрения из-за увеличения осмоляльности преломляющих сред глаза и парестезии (из-за избытка глюкозы в периферических нервах).
Сахарный диабет тип 2
Сахарный диабет тип 2 – широко распространённое заболевание, и на него приходится около 80% всех больных диабетом. У большинства больных он проявляется в возрасте старше 40 лет, и в прошлом его называли «СД пожилых». У 70-80% больных СД тип 2 развивается на фоне ожирения, и оттого он назывался «диабет тучных».
В основе развития СД тип 2 лежит несколько генетических дефектов, полностью отличных от дефектов СД тип 1. Основное значение имеет дефект в гене рецепторов инсулина, проявляющийся снижением чувствительности рецепторов периферических тканей к инсулину, на пострецепторном уровне. Существенное значение в развитии СД тип 2 имеет туловищное (абдоминальное) ожирение на фоне которого у 70-80% лиц развивается СД тип 2. Туловищное, или гипертрофическое, ожирение характеризуется наличием инсулинрезистентности и гиперинсулинемии.
Выделяют две подгруппы СД тип 2: подгруппа с ожирением и подгруппа без ожирения.
1. Подгруппа СД тип 2 с ожирением. Обычно это туловищное, гипертрофическое ожирение. В эту подгруппу входят более 80% больных СД тип 2. В основе заболевания лежит инсулинрезистентность из-за генетического дефекта в рецепторах инсулина. Туловищное ожирении, характеризующееся повышенным количеством жира в жировых клетках, ещё более увеличивает инсулинрезистентность. Лечение низкокалорийной диетой и снижение массы тела у многих больных может уменьшать инсулинрезистентность и гиперинсулинемию и нормализовать уровень глюкозы в плазме крови.
2. Подгруппа СД тип 2 без ожирения. В эту подгруппу входит около 20 % больных диабетом. Основной причиной в развитии этого типа диабета является снижение чувствительности В-клеток к глюкозе. Одновременно имеет место и инсулинрезистентность. Возможно, в эту подгруппу входят другие специфические типы СД.
В отличие от СД тип 1, при СД тип 2 клинические проявления менее выражены, а у 50% больных с ожирением, имеющих умеренную гипергликемию, диабет длительно может протекать асимптоматично и нередко выявляется случайно. У других больных умеренно выражены жажда, полиурия, без снижения массы тела. Женщины часто жалуются на зуд в области половых органов, может быть вульвовагинит. По поводу этих жалоб больные могут обращаться к гинекологу. Нередко возникают нарушения зрения и, при обращении к окулистам, выявляют диабетическую ретинопатию, развивающуюся при длительно текущем недиагностированном диабете. Больных могут беспокоить боли в конечностях, особенно нижних, парестезии, снижение чувствительности. Это связано с повышением осмоляльности в периферических нервах из-за избытка глюкозы, которая свободно проходит в нервы, так как они инсулинонезависимы. У мужчин нередко возникает эректильная дисфункция.
Дата добавления: 2015-06-12; просмотров: 1611;
