Кинетика ферментативных реакций
Скорость ферментативных реакций зависит от концентрации фермента, субстрата, температуры, рН, наличия активаторов и ингибиторов.
В условиях избытка субстрата скорость реакции прямо пропорциональна концентрации фермента (рис. 3.2).
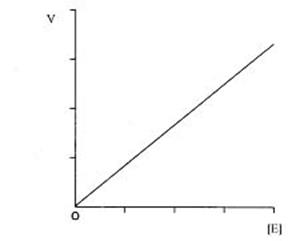
Рис. 3.2. Зависимость скорости реакции от концентрации фермента.
Зависимость скорости реакции от концентрации субстратапредставлена на рисунке 3.3.
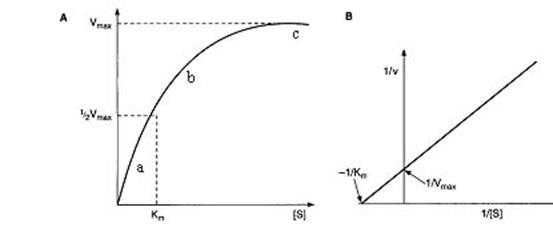
Рис. 3.3. Зависимость скорости реакции от концентрации субстрата.
На графике выделяют 3 участка. При низкой концентрации субстрата (участок а) скорость реакции прямо пропорциональна концентрации субстрата и подчиняется кинетике первого порядка. На участке b (реакция смешанного порядка) эта зависимость нарушается. На участке c скорость реакции максимальна и не зависит от концентрации субстрата.
Ферментативная реакция характеризуется формированием фермент-субстратного комплекса [ES], который распадается с образованием свободного фермента и продукта реакции.
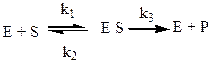
В этом уравнении k1 – константа скорости образования фермент-субстратного комплекса, k2 – константа диссоциации фермент-субстратного комплекса с образованием свободного фермента и субстрата и k3 – константа скорости диссоциации фермент-субстратного комплекса до свободного фермента и продукта реакции.
Михаэлис и Ментен предложили уравнение, которое описывает зависимость скорости реакции от концентрации субстрата.
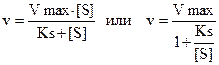
v – скорость реакции при данной концентрации субстрата; Ks – константа диссоциации фермент-субстратного комплекса; Vmax – максимальная скорость реакции.
Ks=k-2/k1 т.е. отношение константы обратной реакции к константе прямой реакции.
Однако данное уравнение описывает только участок а на графике и не учитывает влияния на скорость ферментативного процесса продуктов реакции.
Холдейн и Бриггс заменили в уравнении константу диссоциации на константу Михаэлиса (Кm).
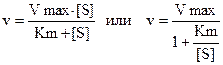
Константа Михаэлиса численно равна концентрации субстрата, при которой скорость реакции равна половине максимальной. Константа Михаэлиса характеризует сродство фермента и субстрата. Высокое сродство фермента к субстрату характеризуется низкой величиной Кm и наоборот.
Использование графика, предложенного Михаэлисом и Ментен неудобно. Для более удобного графического представления Г.Лайнуивер и Д.Бэрк преобразовали уравнение Холдейна и Бриггса по методу двойных обратных величин, исходя из того принципа, что если существует равенство между двумя величинами, то и обратные величины также будут равны.

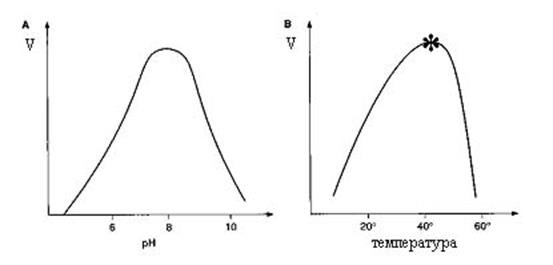
Графическое изображение зависимости скорости реакции от рН имеет колоколообразную форму. Значение рН, при котором фермент проявляет максимальную активность, называется оптимумом рН (рис. 5.4 А). Для большинства ферментов оптимум рН равен 6-8. Исключение составляет пепсин, оптимум которого равен 2,0. При изменении рН в ту или другую сторону от оптимума скорость реакции уменьшается, вследствие ионизации функциональных групп фермента и субстрата, что нарушает образование фермент-субстратного комплекса.
А Б
Рис. 3.4. Зависимость скорости реакции от рН (А) и температуры (Б).
Скорость химической реакции повышается в 2 раза при повышении температуры на 10°С. Однако вследствие белковой природы фермента при дальнейшем повышении температуры наступает денатурация фермента. Температура, при которой скорость реакции максимальна, называется температурным оптимумом (рис. 3.4. Б). Для большинства ферментов оптимум температуры составляет 37-40°С. Исключение составляет миокиназа мышц, которая выдерживает нагревание до 100°С.
Активаторы ферментов – это вещества 1) формирующие активный центр фермента (Co2+,Mg2+, Zn2+, Fe2+, Са2+); 2) облегчающие образование фермент-субстратного комплекса (Мg2+); 3) восстанавливающие SH-группы (глутатион, цистеин, меркаптоэтанол); 4) стабилизирующие нативную структуру белка-фермента. Активируют ферментативные реакции обычно катионы (в таблице Менделеева с 19 по 30). Анионы менее активны, хотя ионы хлора и анионы некоторых других галогенов могут активировать пепсин, амилазу, аденилатциклазу. Активаторами могут быть белки: апопротеин А-I (ЛХАТ), апопротеин С-II (ЛПЛ).
Механизм действия активаторов:
1) участвуют в формировании активного центра ферментов;
2) облегчают связывание субстрата и фермента;
3) участвуют в формировании нативной структуры фермента.
Ингибиторы– вещества, вызывающие частичное или полное торможение реакций, катализируемых ферментами.
Ингибиторы классифицируются на неспецифические и специфические. Действие неспецифических ингибиторов не связано с механизмом действия ферментов. Эти ингибиторы вызывают денатурацию белка-фермента (нагревание, кислоты, щелочи, соли тяжелых металлов и др.).
Специфические ингибиторы влияют на механизм действия ферментов. Специфические ингибиторы делятся на 2 группы: обратимые и необратимые. Необратимые ингибиторы вызывают стойкое необратимое изменение или модификацию функциональных групп фермента путем прочного или ковалентного связывания. К этой группе относятся: 1) ингибиторы металлосодержащих ферментов (HCN, RCN, HF, CO и др.). Эти соединения связываются с металлами с переменной валентностью (Cu или Fe), в результате чего нарушается процесс переноса электронов по дыхательной цепи ферментов. Поэтому эти ингибиторы называются дыхательными ядами. 2) ингибиторы ферментов, содержащих SH-группы (монойодацетат, дийодацетат, йодацетамид, соединения мышьяка и ртути). 3) ингибиторы ферментов, содержащих ОН-группу в активном центре (фосфороорганические соединения, инсектициды). Эти ингибиторы тормозят, прежде всего, активность холинэстеразы – фермента, играющего первостепенную роль в деятельности нервной системы.
Обратимое ингибирование поддается количественному изучению на основе уравнения Михаэлиса-Ментен. Обратимые ингибиторы делятся на конкурентные и неконкурентные.
Конкурентные ингибиторы – это вещества по структуре похожие на субстрат. Ингибитор связывается с активным центром фермента и препятствует образованию фермент-субстратного комплекса.
Классическим примером конкурентного ингибирования является торможение сукцинатдегидрогеназы малоновой кислотой. Сукцинатдегидрогеназа катализирует окисление янтарной кислоты (сукцината) путем дегидрирования в фумаровую кислоту.
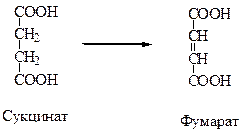
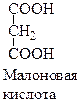
Если в среду добавить малоновую кислоту (ингибитор), то в результате структурного сходства с истинным субстратом сукцинатом он будет реагировать с активным центром с образованием фермент-ингибиторного комплекса, однако реакция происходить не будет.
Действие ингибитора устраняется путем увеличения концентрации субстрата. При конкурентном ингибировании изменяется кинетика ферментативных реакций: увеличивается Кm, Vmax остается постоянной(рис. 3.5).
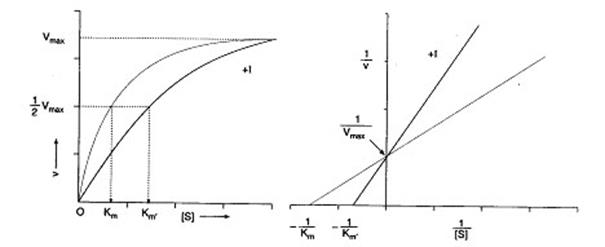
Рис. 3.5. Влияние конкурентных ингибиторов на скорость ферментативной реакции
Метод конкурентного ингибирования нашел применение в медицинской практике, в качестве антиметаболитов.
Например, для лечения некоторых инфекционных заболеваний, вызываемых бактериями, применяют сульфаниламидные препараты. Эти препараты имеют структурное сходство с парааминобензойной кислотой, которую бактериальная клетка использует для синтеза фолиевой кислоты, необходимой для жизнедеятельности бактерий. Благодаря этому структурному сходству сульфаниламид блокирует действие фермента путем вытеснения парааминобензойной кислоты из комплекса с ферментом, синтезирующим фолиевую кислоту.
Неконкурентные ингибиторы – вещества, не имеющие структурного сходства с субстратами. Неконкурентные ингибиторы связываются не с активным центром, а в другом месте молекулы фермента, например, в аллостерическом центре. Это изменяет конформацию активного центра таким образом, что нарушается взаимодействие с ним субстрата.
При неконкурентном ингибировании: Vmax уменьшается, а Km не изменяется (рис. 3.6).
Дата добавления: 2015-06-12; просмотров: 1804;
