МОЛЕКУЛЯРНО-КИНЕТИЧЕСКИЕ ПРЕДСТАВЛЕНИЯ
Молекулярная физика и термодинамика - разделы физики, изучающие макроскопические процессы в телах, состоящих из огромного числа частиц - атомов и молекул. У них общий объект изучения, но различные методы. Молекулярная физика изучает свойства тел на основе рассмотрения их молекулярного строения. Термодинамика не обращается к атомно-молекулярному строению вещества, а исходит из нескольких фундаментальных законов (называемых началами термодинамики), которые получены путем обобщения большого количества опытных фактов.
Молекулярная физика изучает строение вещества, исходя из молекулярно-кинетических представлений, основывающихся на том, что все тела состоят из молекул, находящихся в непрерывном хаотическом движении. Идея об атомном строении вещества высказана впервые древнегреческим философом Демокритом (460 - 370 гг. до н. э.). Во время прогулки по берегу моря он наблюдал увлажнение одежды и пришел к выводу, что тела состоят из мельчайших неделимых частиц - атомов. В течение многих веков учение об атомах запрещалось церковью. Вновь атомистика возрождается лишь в XVII в. в трудах М.В. Ломоносова. Строгое развитие эта наука получила в XIX в. и связана с работами Клаузиуса, Максвелла, Больцмана и др.
Для построения молекулярно-кинетической теории надо знать размеры атомов. Оценки показывают, что размеры атомов порядка нескольких ангстрем. Ангстрем - это внесистемная единица длины, 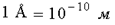 .
.
Число атомов или молекул в любом макроскопическом теле огромно. Например, найденное опытным путем число атомов в 12 г изотопа углерода 12С равно 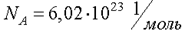 . Это число называется числом Авогадро.
. Это число называется числом Авогадро.
В молекулярной физике вводится единица количества вещества - моль (в системе СИ).
Один моль - это количество вещества, в котором содержится столько же молекул (или атомов), сколько атомов содержится в углероде массой 0,012 кг. Отсюда следует: в одном моле любого вещества содержится одинаковое число атомов или молекул, это число называется числом Авогадро.
Так как массы атомов очень малы, удобно использовать в расчетах не массы, измеренные в килограммах, а относительные массы. Относительной молекулярной (или относительной атомной) массой называют отношение массы молекулы (или атома) вещества к 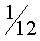 массы атома углерода. Относительные атомные массы указаны в таблице Менделеева.
массы атома углерода. Относительные атомные массы указаны в таблице Менделеева.
Наряду с относительной молекулярной массой в физике и химии используется понятие молярная масса. Молярная масса вычисляется как масса одного моля вещества, выраженная в килограммах (в системе СИ). Например, молекулярная масса воды (Н2О) находится с помощью таблицы Менделеева и равна
М = 1∙2 + 16 = 18.
Молярная масса воды 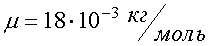 .
.
Дата добавления: 2015-06-10; просмотров: 1207;
